题目内容
【题目】根据要求回答下列有关问题。
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0kJ/mol
②Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H2=-28.0kJ/mol
2Fe(s)+3CO2(g)△H2=-28.0kJ/mol
③C(石墨)+CO2(g)=2CO(g)△H3=akJ/mol
则a=_______kJ/mol。
(2)工业合成氨时,合成塔中每产生1molNH3放出46.1kJ的热量。
某小组研究在500℃下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ | ||
N2 | H2 | NH3 | |||
a | 1 | 4 | 0 | t1min | 放出热量:27.66kJ |
b | 2 | 8 | 0 | t2min | 放出热量:Q |
①容器a中,0~t1时间的平均反应速率为v(H2)=_______。
②容器b中反应达平衡状态时,Q_______55.32kJ;平衡时,容器中H2的转化率:a_______b(填“>”或“<”或“=”)。
(3)以氨为原料,合成尿素的反应原理为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)△H=akJ·mol-1。
CO(NH2)2(l)+H2O(g)△H=akJ·mol-1。
为研究平衡时CO2的转化率与反应物投料比[![]() ]及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。
]及温度的关系,研究小组在10L恒容密闭容器中进行模拟反应,(Ⅰ、Ⅱ曲线分别表示在不同投料比时,CO2的转化率与温度之间的关系)。
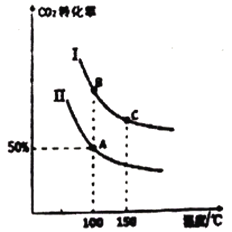
①a_______0(填“>”或“<”)。
②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.5,在100℃条件下发生反应,达平衡至
③A点平衡常数与B点平衡常数间的关系:KA_______KB;
B点平衡常数与C点平衡常数间的关系,KB_______KC(填“>”或“<”或“=”)
【答案】 +172.3 ![]() mol·L-1·min-1 > < < 2∶3 = >
mol·L-1·min-1 > < < 2∶3 = >
【解析】(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0kJ/mol;②Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)△H2=-28.0kJ/mol;由①
2Fe(s)+3CO2(g)△H2=-28.0kJ/mol;由①![]() ②
②![]() 可得③,所以a=
可得③,所以a=![]() +172.3 。
+172.3 。
(2)工业合成氨时,合成塔中每产生1molNH3放出46.1kJ的热量,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.2 kJ·mol-1。由题中数据可知,放出27.66kJ热量时,生成了0.6mol氨气,则消耗0.9mol氢气。①容器a中,0~t1时间的平均反应速率为v(H2)=
2NH3(g) ΔH=-92.2 kJ·mol-1。由题中数据可知,放出27.66kJ热量时,生成了0.6mol氨气,则消耗0.9mol氢气。①容器a中,0~t1时间的平均反应速率为v(H2)=![]() mol·L-1·min-1。②容器b中的投料为容器a的2倍,若将其投在在体积为2VL的容器中,则可建立与a等效的平衡,此时可放出55.32kJ的热量,然后将容器加压至VL,平衡向正反应方向移动,所以反应达平衡状态时,Q>55.32kJ;平衡时,容器中H2的转化率:a<b。
mol·L-1·min-1。②容器b中的投料为容器a的2倍,若将其投在在体积为2VL的容器中,则可建立与a等效的平衡,此时可放出55.32kJ的热量,然后将容器加压至VL,平衡向正反应方向移动,所以反应达平衡状态时,Q>55.32kJ;平衡时,容器中H2的转化率:a<b。
(3)以氨为原料,合成尿素的反应原理为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)△H=akJ·mol-1。①由图象可知,CO2的转化率随温度升高而减小,所以该反应为放热反应,a<0。②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.5,则n(NH3)起始=20mol,在100℃条件下发生反应,达平衡至A点,由图可知,A点对应CO2的转化率为50%,则NH3(g)、CO2(g)、H2O(g)的平衡量分别为10mol、5mol、5mol,在同温同体积条件下,气体的压强之比等于其物质的量之比,所以A点压强与起始压强比为(10+5+3):(10+20)= 2∶3。③A点与B点处于相同温度下,所以A点平衡常数与B点平衡常数间的关系为KA = KB;B点所处的温度低于C点,由于该反应为放热反应,所以B点平衡常数与C点平衡常数间的关系为KB>KC。
CO(NH2)2(l)+H2O(g)△H=akJ·mol-1。①由图象可知,CO2的转化率随温度升高而减小,所以该反应为放热反应,a<0。②若n(CO2)起始=10mol,曲线Ⅱ的投料比为0.5,则n(NH3)起始=20mol,在100℃条件下发生反应,达平衡至A点,由图可知,A点对应CO2的转化率为50%,则NH3(g)、CO2(g)、H2O(g)的平衡量分别为10mol、5mol、5mol,在同温同体积条件下,气体的压强之比等于其物质的量之比,所以A点压强与起始压强比为(10+5+3):(10+20)= 2∶3。③A点与B点处于相同温度下,所以A点平衡常数与B点平衡常数间的关系为KA = KB;B点所处的温度低于C点,由于该反应为放热反应,所以B点平衡常数与C点平衡常数间的关系为KB>KC。

 特高级教师点拨系列答案
特高级教师点拨系列答案