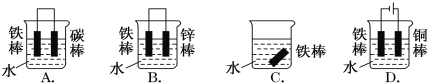
��Ŀ����
����Ŀ��ij�¶�����2L�ܱ������м���һ����A���������»�ѧ��Ӧ��
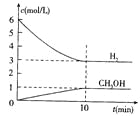
2A(g)![]() B(g)+C(g)����H =��48.25 kJ��mol��1����Ӧ������B��A��Ũ�ȱ���ʱ��t����ͼ��ʾ��ϵ������õ�15minʱc(B)=1.6 mol��L��1�����н�����ȷ����
B(g)+C(g)����H =��48.25 kJ��mol��1����Ӧ������B��A��Ũ�ȱ���ʱ��t����ͼ��ʾ��ϵ������õ�15minʱc(B)=1.6 mol��L��1�����н�����ȷ����

A.���¶��´˷�Ӧ��ƽ�ⳣ��Ϊ3.2
B.A�ij�ʼ���ʵ���Ϊ4 mol
C.��Ӧ����ƽ��ʱ���ų���������193kJ
D.��Ӧ��ƽ��ʱ��A��ת����Ϊ80%
���𰸡�D
��������
����c��B��=1.6 mol/L��n��B��=3.2mol����ͼ����֪n��A��=1.6mol�����������������֪��

���Լ����x=8mol������ƽ��ʱA��B��C��Ũ�ȷֱ�Ϊ0.8mol/L��1.6mol/L��1.6mol/L��
A.ƽ�ⳣ��K=![]() =4������
=4������
B.A��ʼΪ8mol������
C.����ƽ������3.2mol B���ų���������3.2��48.25=154.4kJ��C����
D.��Ӧ��ƽ��ʱ��A��ת����Ϊ![]() ��100%=80����D��ȷ��
��100%=80����D��ȷ��
��ѡD��

��ϰ��ϵ�д�
 �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�
�����Ŀ