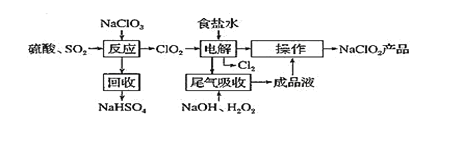
��Ŀ����
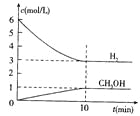
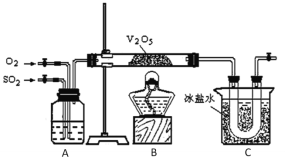
����Ŀ��ij�о���ѧϰС���ͬѧΪ��ʵ�������ֶ�������������Ĺ��̣�����ȡ�������������壬�������ͼ��ʾ��װ�á���֪����������ˮ�������Ტ�ų������ȣ������γ��������Իش�
��1����֪450��ʱ����Ӧ2SO2(g)��O2(g)![]() 2SO3(g)��ƽ�ⳣ��K��25������450��ʱ��2SO3(g)
2SO3(g)��ƽ�ⳣ��K��25������450��ʱ��2SO3(g)![]() 2SO2(g)��O2(g)�Ļ�ѧƽ�ⳣ��Ϊ___��
2SO2(g)��O2(g)�Ļ�ѧƽ�ⳣ��Ϊ___��
��2��A�е��Լ���___��
��3����ʵ������в��س������ȣ�˵����ƽ��ġ�H___0������>��������������<����,Cװ�������ռ������������б���ˮ��������___������32gͭ������Ũ���ᷴӦ��ȡ��������ʵ�����ʱ�õ�20g��������ʵ���ж��������ת���ʲ�С��___��
��4����ָ������ʵ��װ�õ�����ȱ���ǣ�___��
���𰸡�0.04 ŨH2SO4 �� ��ȴSO3�Եõ����� 50% ȱ��β������װ��
��������
(1)��ͬ�����£����淴Ӧ�Ļ�ѧƽ�ⳣ����Ϊ�������ݴ˷������㣻
(2)����ͼʾ������Ӳ�ʲ����ܵ�������Ҫ����ݴ˷����жϣ�
(3)��ʵ������в��س������ȣ�˵���÷�ӦΪ���ȷ�Ӧ���������������۷е�������32gͭ�����ʵ���=![]() =0.5mol������2H2SO4(Ũ) + Cu
=0.5mol������2H2SO4(Ũ) + Cu![]() CuSO4 + 2H2O +SO2�����������ϵõ������������ټ�����������ת���ʣ�
CuSO4 + 2H2O +SO2�����������ϵõ������������ټ�����������ת���ʣ�
(4)�÷�ӦΪ���淴Ӧ��β����һ�����ж������ݴ˷������
(1)��ͬ�����£����淴Ӧ�Ļ�ѧƽ�ⳣ����Ϊ�����������450��ʱ��2SO3(g)![]() 2SO2(g)��O2(g)�Ļ�ѧƽ�ⳣ��=
2SO2(g)��O2(g)�Ļ�ѧƽ�ⳣ��=![]() =0.04���ʴ�Ϊ��0.04��
=0.04���ʴ�Ϊ��0.04��
(2)����ͼʾ������Ӳ�ʲ����ܵ�������Ҫ������A�е��Լ�ΪŨ���ᣬ�ʴ�Ϊ��ŨH2SO4��
(3)��ʵ������в��س������ȣ�˵���÷�ӦΪ���ȷ�Ӧ����H��0��Cװ�������ռ������������б���ˮ������ȴSO3�Եõ����������壻32gͭ�����ʵ���=![]() =0.5mol������2H2SO4(Ũ) + Cu
=0.5mol������2H2SO4(Ũ) + Cu![]() CuSO4 + 2H2O +SO2����֪�������ϸ�����Ũ���ᷴӦ��������0.5mol������������ȫת�����ܹ��õ�0.5mol�����������ʵ���ж��������ת���ʲ�С��
CuSO4 + 2H2O +SO2����֪�������ϸ�����Ũ���ᷴӦ��������0.5mol������������ȫת�����ܹ��õ�0.5mol�����������ʵ���ж��������ת���ʲ�С��![]() ��100%=50%���ʴ�Ϊ��������ȴSO3�Եõ����壻50%��
��100%=50%���ʴ�Ϊ��������ȴSO3�Եõ����壻50%��
(4)�÷�ӦΪ���淴Ӧ��β����һ�����ж���������Ⱦ�������ʴ�Ϊ��ȱ��β������װ�á�

 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�