题目内容
(14 分)在T1℃时,向容积为2 L 的密闭容器甲中加人1mol N1、3mol H2及少量固体催 化剂,发生反应N2(g) + 3H2(g)  2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
(1) 该反应在0 ~l0min 时间内H2的平均反应速率为______,N2的转化率为______。
 (2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
(2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
a.大于25% b.等于25% c.小于25%
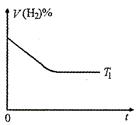
(3)右图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T1>T2)时H2的体积分数随时间t的变化曲线。
(4)若保持T1℃,在体积也为2 L 的密闭容器乙中通入一定量的N2、H2、NH3,欲使平衡时容器乙中各物质的物质的量与容器甲中完全相同,且起始时反应向正反应方向进行,则通入H2的物质的量x的取值范围是____________。
 2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。(1) 该反应在0 ~l0min 时间内H2的平均反应速率为______,N2的转化率为______。
 (2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
(2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。a.大于25% b.等于25% c.小于25%
(3)右图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T1>T2)时H2的体积分数随时间t的变化曲线。
(4)若保持T1℃,在体积也为2 L 的密闭容器乙中通入一定量的N2、H2、NH3,欲使平衡时容器乙中各物质的物质的量与容器甲中完全相同,且起始时反应向正反应方向进行,则通入H2的物质的量x的取值范围是____________。
⑴0.06mol·L-1·min-1 (2分) 40% (3分) ⑵ c (3分)
⑶ (3分) ⑷ 1.8mol< x <3mol (3分)
(3分) ⑷ 1.8mol< x <3mol (3分)
⑶
 (3分) ⑷ 1.8mol< x <3mol (3分)
(3分) ⑷ 1.8mol< x <3mol (3分)(1)设达平衡时,体系内生成2x mol NH3,则有: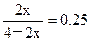 ,解得x=0.4mol,△c(H2)=0.6mol·L-1,△t=10min,故v(H2)=0.06mol·L-1 ·min-1。N2的转化率=
,解得x=0.4mol,△c(H2)=0.6mol·L-1,△t=10min,故v(H2)=0.06mol·L-1 ·min-1。N2的转化率= =40%。
=40%。
(2)加入0.5mol N2、1.5mol H2、0.5mol NH3相当于加入0.75mol N2、2.25mol H2,与原平衡相比,N2、H2浓度都小于原平衡,所以降低浓度导致反应物的转化率降低,达平衡时体系内NH3的体积分数小于25%。
(3)因T2>T1,所以在T2温度下反应速率更快,达平衡时间更短,但达平衡时H2的体积分数比T1时高,据此可画出对应变化曲线。
(4)甲容器中达平衡时n(H2)=1.8mol,所以x至少应大于1.8mol,要使大平衡时N2、H2、NH3浓度与甲平衡相同,则x<3mol,故有:1.8mol<x<3mol。
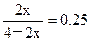 ,解得x=0.4mol,△c(H2)=0.6mol·L-1,△t=10min,故v(H2)=0.06mol·L-1 ·min-1。N2的转化率=
,解得x=0.4mol,△c(H2)=0.6mol·L-1,△t=10min,故v(H2)=0.06mol·L-1 ·min-1。N2的转化率= =40%。
=40%。(2)加入0.5mol N2、1.5mol H2、0.5mol NH3相当于加入0.75mol N2、2.25mol H2,与原平衡相比,N2、H2浓度都小于原平衡,所以降低浓度导致反应物的转化率降低,达平衡时体系内NH3的体积分数小于25%。
(3)因T2>T1,所以在T2温度下反应速率更快,达平衡时间更短,但达平衡时H2的体积分数比T1时高,据此可画出对应变化曲线。
(4)甲容器中达平衡时n(H2)=1.8mol,所以x至少应大于1.8mol,要使大平衡时N2、H2、NH3浓度与甲平衡相同,则x<3mol,故有:1.8mol<x<3mol。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
 3C(g)达到平衡时,A.B和C的物质的量分别为3mol、2mol和4mol,若温度不变,向容器内的平衡混合物中再加入A、C各lmol,此时该平衡移动的方向为
3C(g)达到平衡时,A.B和C的物质的量分别为3mol、2mol和4mol,若温度不变,向容器内的平衡混合物中再加入A、C各lmol,此时该平衡移动的方向为 2C(g) + D(s) ,可以判断反应达到平衡是( )
2C(g) + D(s) ,可以判断反应达到平衡是( ) pC(g)的可逆反应,在室温条件下φ(B)与压强(p)的关系如图4所示,则下列有关叙述正确的是( )
pC(g)的可逆反应,在室温条件下φ(B)与压强(p)的关系如图4所示,则下列有关叙述正确的是( )
 CO2(g)+H2(g),此时有
CO2(g)+H2(g),此时有 的CO转化为CO2。计算平衡状态下混合气体中CO2的体积分数。
的CO转化为CO2。计算平衡状态下混合气体中CO2的体积分数。 2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍?
2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍? 2Z(g);
2Z(g);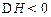 。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是 ( )
。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是 ( ) CH3OH(g) △H<0, 为了增加产量,提高效率,宜采用的反应条件是( )。
CH3OH(g) △H<0, 为了增加产量,提高效率,宜采用的反应条件是( )。