题目内容
在10L密闭容器中,放入8.0gSO3在一定条件下反应:2SO3(g)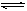 2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍?
2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍?
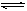 2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍?
2SO2(g)+O2(g)并达到平衡状态,SO3的分解率为40%,求平衡混合气密度是相同条件下H2密度的多少倍?平衡时混合气密度是相同条件下H2密度的33.34倍
2SO3(g)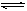 2SO2(g)+O2(g)
2SO2(g)+O2(g)
起始物质的量/mol 0.1 ? ?0 ? ?0
转化物质的量/mol 0.04 ? 0.04 ? ?0.02
平衡物质的量/mol 0.06 ? 0.04 ? ?0.02
∴?n总=0.06mol+0.04mol+0.02mol
?=0.12mol
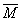 =(m总/n总)=(8.0/0.12)=66.67
=(m总/n总)=(8.0/0.12)=66.67
∴(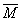 /MH2)=(66.67/2)=33.34
/MH2)=(66.67/2)=33.34
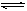 2SO2(g)+O2(g)
2SO2(g)+O2(g)起始物质的量/mol 0.1 ? ?0 ? ?0
转化物质的量/mol 0.04 ? 0.04 ? ?0.02
平衡物质的量/mol 0.06 ? 0.04 ? ?0.02
∴?n总=0.06mol+0.04mol+0.02mol
?=0.12mol
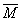 =(m总/n总)=(8.0/0.12)=66.67
=(m总/n总)=(8.0/0.12)=66.67∴(
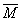 /MH2)=(66.67/2)=33.34
/MH2)=(66.67/2)=33.34
练习册系列答案
相关题目
 2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。
2NH3(g);△H<0,10min时各物质的浓度不再变化,测得NH3 的体积分数为25% 。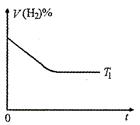 (2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。
(2)在T1℃时,若起始时在容器甲中加入0.5mol N2、1.5mol H2、0.5mol NH3 ,则达到平衡时NH3的体积分数______ (填选项字母) 。 Na2S(s)+4H2O(g);ΔH>0
Na2S(s)+4H2O(g);ΔH>0
 2SO3(气)
2SO3(气)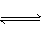 2C(气)达平衡的标志是( )
2C(气)达平衡的标志是( )
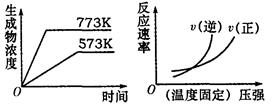
 2NH3(g)△H=—Q1kJ·mol—1(Q1>0)
2NH3(g)△H=—Q1kJ·mol—1(Q1>0) cC(g)+dD(g),达平衡后,改变某条件时,发生右图所示的变化,下列选项叙述正确的是( )
cC(g)+dD(g),达平衡后,改变某条件时,发生右图所示的变化,下列选项叙述正确的是( )
 X2(g)+Y2(g)达到平衡的标志是( )
X2(g)+Y2(g)达到平衡的标志是( )