��Ŀ����
����Ŀ����ˮ���̲��ŷḻ����Դ����ˮ�ۺ����õIJ�������ͼ���£�
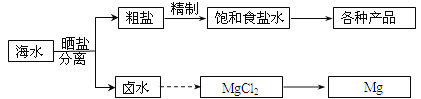
�ش��������⣺
��1����NaCl��ԭ�Ͽ��Եõ����ֲ�Ʒ
�ٹ�ҵ����NaCl�Ʊ������ƵĻ�ѧ����ʽ��________________��
��ʵ�����ö��Ե缫���200mLNaCl��Һ���������������õ�224mL���壨��״��������������Һ��pHΪ_________�����Է�Ӧǰ����Һ������仯����
�۵���Ȼ���ϡ��Һ���Ʊ���84������Һ����84������Һ����Ч�ɷ�Ϊ______����ȡ���Ļ�ѧ����ʽΪ__________________________��
��2����������κ��±ˮ���̺��ŷḻ��þ��Դ����ת����ɻ��MgCl2�ֲ�Ʒ����±ˮ����ȡþ�IJ���Ϊ��
a�������ߴ������ڵı������ճ�ʯ�ң�����ʯ���Ƴ�ʯ���飻
b����ʯ������뵽��ˮ�������о����˵õ�Mg(OH)2������
c����Mg(OH)2�����м�������õ�MgCl2��Һ���پ������ᾧ�õ�MgCl26H2O��
d����MgCl26H2O��һ�������¿��Եõ���ˮMgCl2��
e��������ڵ�MgCl2�ɵõ�Mg��
��������ȡþ������c�У��õ�MgCl2��Һ�����ӷ���ʽΪ______________��
�ڲ���d�е���һ��������ָ����___________________��
����ͬѧ��Ϊ������b��ɼ���Mg(OH)2�õ�MgO���ٵ�����ڵ�MgO�ƽ���þ�������ɼ�ʵ�鲽�裬����ʵ��ļ�Լ��ԭ����ͬ���ͬѧ���뷨��__________������ͬ����������ͬ����������˵����ͬ���ͬ�������______________��
���𰸡�2NaCl�����ڣ�![]() 2Na+Cl2�� 13 NaClO NaCl+H2O
2Na+Cl2�� 13 NaClO NaCl+H2O![]() NaClO+H2�� Mg(OH)2+2H+= Mg2++2H2O ��HCl�����м��� ��ͬ�� ��ΪMgO�۵�ܸߣ�����ʱ�����Ĵ����ĵ��ܶ����������ɱ�
NaClO+H2�� Mg(OH)2+2H+= Mg2++2H2O ��HCl�����м��� ��ͬ�� ��ΪMgO�۵�ܸߣ�����ʱ�����Ĵ����ĵ��ܶ����������ɱ�
��������
��1�������ƱȽϻ��ã���ȡʱֻ�ܲ��õ��ķ���������ʽΪ��2NaCl�����ڣ�![]() 2Na+Cl2�����ڵ�ⱥ��ʳ��ˮ�������õ������������õ����������������ʵ���Ϊ��
2Na+Cl2�����ڵ�ⱥ��ʳ��ˮ�������õ������������õ����������������ʵ���Ϊ��![]() =0.005mol����2NaCl+2H2O
=0.005mol����2NaCl+2H2O![]() Cl2��+H2��+2NaOH ��֪��Cl2����H2����2NaOH����n��NaOH��=2n��Cl2��=2��0.005mol=0.01mol��c��NaOH��=
Cl2��+H2��+2NaOH ��֪��Cl2����H2����2NaOH����n��NaOH��=2n��Cl2��=2��0.005mol=0.01mol��c��NaOH��=![]() =0.1mol/L������pH=13��
=0.1mol/L������pH=13��
����84������ҺΪ����������Һ������Ȼ�����Һ��ȡ�������Ƶķ���ʽΪ��NaCl+H2O![]() NaClO+H2��
NaClO+H2��
��2������Mg(OH)2�����м�������õ�MgCl2��Һ��������Ӧ�����ӷ���ʽΪMg(OH)2+2H+= Mg2++2H2O��
��MgCl26H2O��һ�������¼��ȵõ���ˮMgCl2����ֱ�Ӽ���MgCl26H2O����ٽ�Mg2+ˮ�⣬�ò�����ˮMgCl2����Mg2+ˮ������ԣ�����������Ȼ��������п�����Mg2+ˮ�⣬��һ������Ϊ��HCl�����У�Ŀ��������Mg2+ˮ�⣻
������þ�۵�ܸߣ�����ʱ�����Ĵ����ĵ��ܶ����������ɱ����ʲ�ͬ���ͬѧ���뷨��

����Ŀ��ij��Ȥ�С���������ʼ�Ļ��䣬��Ƴ�һ��ƽ��ħ��������ͼ��ʾ��
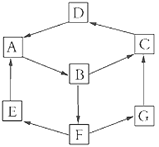
��֪��A��B��C��D��G����ͬ��Ԫ�ء�
��
��A(����) | B��Һ | D���� | G��Һ | |
��ɫ | ����ɫ | ��ɫ | ����ɫ | dz��ɫ |
��E��ͨ��������ܶ���С�����壻B����������Һ��Ӧ���ɲ�����ϡ����İ�ɫ������Ҳ�ܽ�һ������������ΪF��F�Ǻ�������Ԫ�صĻ������A��Ӧ����E��G��
����������Ϣ��գ�
(1)д��D�Ļ�ѧʽ��___________________________________________��
(2)G����C�Ĺ����������ֵ�����Ϊ_________________________��
(3)д����ӦA��B�Ļ�ѧ����ʽ��_________________________________��
(4)B��F�����ӷ���ʽΪ________��G������ᷴӦ�����ӷ���ʽΪ________________________________��