题目内容
已知下列热化学方程式:Zn(s)+1/2O2(g)=ZnO(s);△H=-351.1kJ·mol-1
Hg(l)+1/2O2(g)=HgO(s);△H=-90.7 kJ·mol-1,由此可知反应:
Zn(s)+HgO(s)=ZnO(s)+ Hg(l)的△H为。
Hg(l)+1/2O2(g)=HgO(s);△H=-90.7 kJ·mol-1,由此可知反应:
Zn(s)+HgO(s)=ZnO(s)+ Hg(l)的△H为。
| A.△H=-1141.8 kJ·mol-1 | B.△H=+260.4kJ·mol-1 |
| C.△H=+441.8 kJ·mol-1 | D.△H=-260.4 kJ·mol-1 |
D
考查反应热的计算
由①—②式可得到:Zn(s)+HgO(s)=ZnO(s)+ Hg(l) △H=-260.4 kJ·mol-1
答案为D
由①—②式可得到:Zn(s)+HgO(s)=ZnO(s)+ Hg(l) △H=-260.4 kJ·mol-1
答案为D

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1
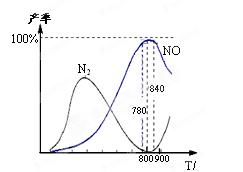
 C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、

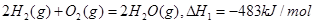 ,则对于热化学方程式:
,则对于热化学方程式: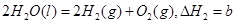 ,下列说法正确的是( )
,下列说法正确的是( )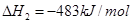
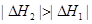
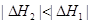
 。
。 4NO(g)+6H2O(g); △H=-905 kJ/mol……①
4NO(g)+6H2O(g); △H=-905 kJ/mol……①