题目内容
下列说法正确的是
A.某温度时, 1LpH=6的水溶液,含 离子 离子 |
B.含10.6gNa2CO3溶液中,所含阴离子总数等于 |
| C.VLamol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3mol。 |
D.电解精炼粗铜时,每转移 电子,阳极上溶解的 电子,阳极上溶解的 原子数必为 原子数必为 |
C
解析试题分析:A. 某温度时,1LpH=6的水溶液, c(H+)=10-6mol/L,由于温度不知道,所以不能确定溶液中OH-的物质的量的多少,错误;B.10.6gNa2CO3的物质的量是0.1mol,由于CO32-会发生水解反应:CO32-+H2O  HCO3-+OH-,因此所含阴离子总数大于0.1mol,错误;C. VLamol/LFeCl3溶液中,由于该盐是强酸弱碱盐,弱酸根离子水解消耗一些Fe3+,因此若溶液中含Fe3+离子数目为1mol,则Cl-离子数目大于3mol,正确;D. 电解精炼粗铜时,由于在粗铜中含有比Cu活泼的金属杂质,所以每转移1mol电子,阳极上溶解的Cu原子数不一定为0.5mol,错误。
HCO3-+OH-,因此所含阴离子总数大于0.1mol,错误;C. VLamol/LFeCl3溶液中,由于该盐是强酸弱碱盐,弱酸根离子水解消耗一些Fe3+,因此若溶液中含Fe3+离子数目为1mol,则Cl-离子数目大于3mol,正确;D. 电解精炼粗铜时,由于在粗铜中含有比Cu活泼的金属杂质,所以每转移1mol电子,阳极上溶解的Cu原子数不一定为0.5mol,错误。
考点:考查弱电解质的电离、盐的水解、电解原理的应用的知识。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是 ,原因为 ;反应速率最小的时间段是 ,原因为 。
(2)在2~3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A .蒸馏水 B .Na2SO4溶液 C. NaNO3溶液 D. CuSO4溶液 E. Na2CO3 溶液,
你认为可行的是 。
常温下,pH = 12的NaOH溶液与pH =1的HC1溶液按一定比例混合,所得溶液pH =2,则NaOH溶液与HC1溶液的体积比为
| A.9:2 | B.2:9 | C.1:9 | D.10:1 |
(原创)已知:HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是
| A.对比等浓度的两种酸的pH |
| B.对比等浓度的两种酸,与相同大小镁条反应的初始速率 |
| C.对比等浓度、等体积的两种酸,与等量NaOH溶液反应后放出的热量 |
| D.对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积 |
下列有关溶液的叙述中,正确的是
| A.中和10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同 |
| B.常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7 |
| C.常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等 |
| D.常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等 |
常温下,已知0.1mol·L-1的CH3COOH和HCN溶液的PH分别为a、b,且1<a< b。下列有关叙述不正确的是( )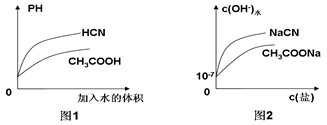
| A.常温下,等浓度的CH3COONa溶液和NaCN溶液的PH前者较小 |
| B.在NaCN溶液中:c (Na+)+ c (H+) =c (OH-)+ c (CN-) |
| C.相同温度下,相同PH的CH3COOH和HCN溶液分别加水稀释,溶液PH随溶液体积变化的曲线如图1所示 |
| D.常温下,CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与盐浓度的变化曲线如图2所示 |
下列叙述正确的是
| A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
B.2SO2(g) + O2(g) 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示 |
C.2NO+2CO 2CO2+N2的ΔH<0,常温下该反应一定能自发进行 2CO2+N2的ΔH<0,常温下该反应一定能自发进行 |
| D.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小 |
下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )
| A.FeC13 | B.Ca(HCO3)2 | C.Na[Al (OH)4] | D.Na2SO3 |