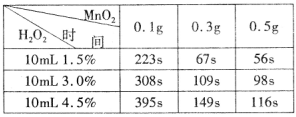
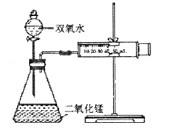
题目内容
某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是 ,原因为 ;反应速率最小的时间段是 ,原因为 。
(2)在2~3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A .蒸馏水 B .Na2SO4溶液 C. NaNO3溶液 D. CuSO4溶液 E. Na2CO3 溶液,
你认为可行的是 。
(1)2~3 min(1分),因该反应是放热反应,此时温度高(2分);4~5 min (1分),因为此时H+ 浓度小(2分)(时间段错误,不得分)
(2)υ(HCl)="0.1" mol/(L·min)(2分,无单位或单位错误扣1分)
(3)A、B (各1分,共2分,多选1个扣1分)
解析试题分析:(1)1~2min生成氢气体积为70ml,2~3min生成氢气体积为112ml,3~4min生成氢气体积为58ml,4~5min生成氢气体积为20ml,所以反应速率最大的时间段为2~3min,因为锌与盐酸的反应为放热反应,2~3min时温度高,反应速率最大;随着反应的进行,盐酸的浓度越来越小,4~5min时H+浓度小,反应速率最小。
(2)首先根据2~3min时间段内生成氢气体积求出反应的HCl浓度:n(H2)=V(H2)÷Vm=0.112L÷22.4L/mol=0.005mol,然后根据化学反应速率公式计算:Zn+2HCl=ZnCl2+H2↑ n(HCl)="2" n(H2)=0.01mol,则υ(HCl)=?c(HCl)÷?t=0.01mol÷0.1L÷1min="0.1" mol/(L·min)。
(3)A、蒸馏水稀释盐酸,浓度减小,反应速率减小,HCl的物质的量不变,产生氢气的量不变,正确;B、加入Na2SO4溶液,对盐酸起到稀释作用,反应速率减小而生成氢气的量不变,正确;C、加入NaNO3溶液,溶液中含有H+、NO3?,Zn与HNO3反应不生成H2,生成的氢气体积会减少,不符合要求;D、加入CuSO4溶液,Zn与CuSO4反应生成Cu,Zn、Cu和盐酸溶液形成原电池,反应速率加快,不符合要求;E、加入Na2CO3 溶液,HCl与Na2CO3反应,与Zn反应的HCl量减少,生成氢气的体积减少,不符合要求。
考点:本题考查化学反应速率的计算和大小比较、条件对化学反应速率的影响。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
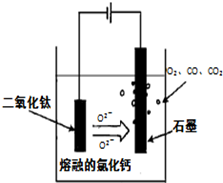
小学生10分钟应用题系列答案(14分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如图,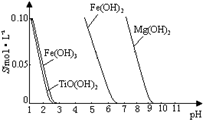
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因 是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始 pH | 废水样品 体积/mL | 草酸溶液 体积/mL | 蒸馏水 体积/mL |
| ① | 4 | | 10 | 30 |
| ② | 5 | 60 | 10 | |
| ③ | | 60 | | 20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
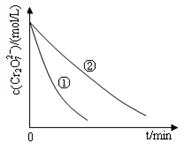
(2)实验①和②的结果表明_______________________________;
(3)该课题组队铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(4)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
硫代硫酸钠(Na2S2O3)俗称大苏打,照相业中用作定影剂。Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成。
(1)Na2S2O3溶液与稀硫酸混合反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5 mL):
| 实验编号 | T/K | c(Na2S2O3)/ mol·L-1 | c(H2SO4)/ mol·L-1 | 实验目的 |
| ① | 298 | 0.1 | 0.1 | 实验①和②探究温度对该反应速率的影响;实验①、③和④探究反应物浓度对该反应速率的影响 |
| ② | 308 | | | |
| ③ | | 0.2 | | |
| ④ | | 0.1 | |
(2)Na2S2O3还具有很强的还原性,Na2S2O3溶液与足量氯水反应的化学方程式为:
________ (提示:S元素被氧化为SO)。
(3)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论。限选试剂: 1 mol·L-1 H2SO4、1 mol·L-1 HNO3、1 mol·L-1 HCl、1 mol·L-1 NaOH、0.1 mol·L-1 BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管中,加蒸馏水溶解 | |
| 步骤2: | |
| 步骤3: | |
某学习小组设计如下实验方案,相关推测不合理的是
| A.试管②滴入酚酞后溶液可能变浅红 |
| B.试管③滴入FeCl3溶液后有红褐色沉淀生成 |
| C.试管④中的变化是物理变化 |
| D.上述反应说明Fe(OH)3溶解性小于Mg(OH)2 |
下列说法正确的是
A.某温度时, 1LpH=6的水溶液,含 离子 离子 |
B.含10.6gNa2CO3溶液中,所含阴离子总数等于 |
| C.VLamol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3mol。 |
D.电解精炼粗铜时,每转移 电子,阳极上溶解的 电子,阳极上溶解的 原子数必为 原子数必为 |
 2 NH3
2 NH3
 2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为