题目内容
下列溶液中有关物质的量浓度关系正确的是( )
A.0.1 mol/L pH=3的H2A溶液与0.01 mol/L pH=11的MOH溶液任意比混合:
c(H+)+c(M+)=c(OH-)+2c(A2-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C
解析试题分析:A.根据溶液呈电中性原理可知:c(H+)+c(M+)=c(OH-)+2c(A2-)+ c(HA-),错误; B.NaOH是强碱,电离使溶液显碱性,而CH3COONa和Na2CO3是强碱弱酸盐,水解使溶液显碱性,盐的水解程度是微弱的,所以当溶液的pH 相等时,盐的浓度远大于碱的浓度,根据盐的水解规律:越弱越水解,盐的水解程度大,所以盐的浓度c(CH3COONa)>c(Na2CO3).故pH相等的CH3COONa、NaOH和Na2CO3三种溶液: c(NaOH)<c(Na2CO3)<c(CH3COONa),错误; C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:根据物料守恒可得c(CH3COO-)+ c(CH3COOH)=2c(Na+), c(CH3COO-)+c(OH-)=c(H+)+c(Na+),将第二个式子代入第一个式子可得:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),正确。D.0.1 mol·L-1的NaHA溶液,其pH=4,说明HA-的电离作用大于水解作用,但是盐的水解作用是微弱的,所以c(HA-)>c(A2-)>c(H2A),在溶液中除了HA-电离外,还存在水的电离,所以c(H+)>c(A2-),所以溶液在离子浓度关系是:c(HA-)>c(H+)>c(A2-)>c(H2A),错误。
考点:考查溶液中微粒浓度的大小比较的知识。

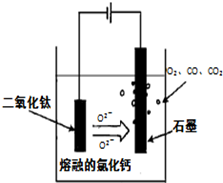
(14分)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。
25 ℃时,难溶电解质溶解度与pH关系如图,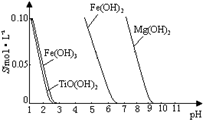
TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因 是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
某学习小组设计如下实验方案,相关推测不合理的是
| A.试管②滴入酚酞后溶液可能变浅红 |
| B.试管③滴入FeCl3溶液后有红褐色沉淀生成 |
| C.试管④中的变化是物理变化 |
| D.上述反应说明Fe(OH)3溶解性小于Mg(OH)2 |
用水稀释0.1mol·L-1 氨水时,溶液中随着水量的增加而减小的是( )
A.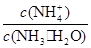 | B.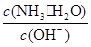 |
| C.c(H+)×c(OH-) | D.OH-的物质的量 |
把0.05molNaOH固体分别加入下列100mL溶液中,溶液的导电能力变化不大的是( )
| A.自来水 | B.0.5mol·L—1KOH溶液 |
| C.0.5mol·L—1醋酸 | D.0.5mol·L—1NH4Cl溶液 |
已知常温下KHSO3溶液的pH<7,且等浓度的HSO3-的电离程度大于SO32-的水解程度。等物质的量的KHSO3、K2SO3、K2SO4溶于足量水形成的溶液中,有关粒子之间的关系正确的是
| A.c(SO42-)>c(HSO3-)>c(SO32-) >c(H2SO3) |
| B.c(K+)>c(SO32-)>c(SO42-)>c(HSO3-)>c(H+)>c(OH-) |
| C.c(K+)=c(HSO3-)+2c(SO32-)+2c(SO42-) |
| D.c(K+)+c(H+)=c(HSO3-)+c(SO32-)+c(SO42-)+c(OH-) |
下列说法正确的是
A.某温度时, 1LpH=6的水溶液,含 离子 离子 |
B.含10.6gNa2CO3溶液中,所含阴离子总数等于 |
| C.VLamol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3mol。 |
D.电解精炼粗铜时,每转移 电子,阳极上溶解的 电子,阳极上溶解的 原子数必为 原子数必为 |
己知25℃时,Ksp(AgCl) =1.8×10-10,Ksp(AgBr) =5.4×10-13,Ksp(AgI) =8.5×10-17。某溶液中含有C1-、Br-和I-,浓度均为0.010mo1·L-1,向该溶液中逐滴加入0.010mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
| A.C1-、Br-、I- | B.Br-、C1-、I- |
| C.I-、Br-、C1- | D.Br-、I-、C1- |
25 ℃在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③pH = 10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×109 |
| C.1∶20∶1010∶109 | D.1∶10 ∶104∶109 |