题目内容
18.向25mL稀HCl和稀H2SO4的混合液中滴入67.5mL 1mol•L-1 NaOH恰好完全中和,如果在这种混合液中加入过量BaCl2溶液所生成的沉淀经洗涤、烘干后称其质量为0.466g,求盐酸和硫酸的物质的量浓度.分析 加入NaOH,发生H++OH-=H2O,根据NaOH的物质的量可计算n(H+),加入氯化钡生成BaSO4,根据生成的质量可计算硫酸的物质的量,进而计算盐酸的物质的量,从而计算浓度.
解答 解:设HCl、H2SO4的物质的量分别为xmol、ymol,加入NaOH,发生H++OH-=H2O,因n(NaOH)=0.0675L×1mol/L=0.0675mol,
则x+2y=0.0675mol,
加入氯化钡生成BaSO4,n(H2SO4)=n(BaSO4)=$\frac{0.466g}{233g/mol}$=0.02mol,
则n(HCl)=0.0675mol-2×0.02mol=0.0275mol,
所以c(HCl)=$\frac{0.0275mol}{0.025L}$=1.1mol/L,c(H2SO4)=$\frac{0.02mol}{0.025L}$=0.8mol/L,
答:盐酸和硫酸的物质的量浓度分别为1.1moL/L、0.8mol/L.
点评 本题考查了酸碱反应的定量关系分析判断和计算方法,注意离子反应的实质和守恒的方向判断,题目难度中等.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
8.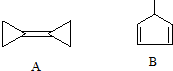 有机化学中的结构可用键线式表示,如CH2=CHCH2Br可表示为
有机化学中的结构可用键线式表示,如CH2=CHCH2Br可表示为 .下列关于两种有机化合物A和B的说法中错误的是( )
.下列关于两种有机化合物A和B的说法中错误的是( )
 有机化学中的结构可用键线式表示,如CH2=CHCH2Br可表示为
有机化学中的结构可用键线式表示,如CH2=CHCH2Br可表示为 .下列关于两种有机化合物A和B的说法中错误的是( )
.下列关于两种有机化合物A和B的说法中错误的是( )| A. | 有机物A分子所有碳原子杂化形式有:sp3和sp2两种 | |
| B. | 有机物B的化学式为C6H8 | |
| C. | 有机物B的一氯取代产物有4种 | |
| D. | 等质量的A和B完全燃烧耗氧量不同 |
8.下列离子方程式正确的是( )
| A. | 碳酸钙中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 少量SO2通入NaOH溶液:SO2+OH-═HSO3- | |
| C. | FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| D. | 硫酸溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
 CH3COO-+H+.
CH3COO-+H+.