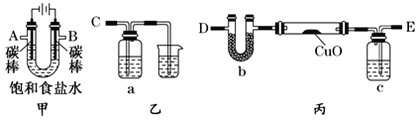
题目内容
【题目】溶液中的化学反应大多数是离子反应,根据要求回答问题
(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性.试用离子方程式表示:①盐碱地产生碱性的原因________、_________;
②Na2CO3溶液中离子浓度大小顺序为__________________________________________;
(2)常温下,等物质的量浓度的①氨水;②NH4HSO4;③NH4Cl;④(NH4)2CO3;⑤(NH4)2SO4溶液中,c(NH4+)由大到小的顺序为 > > > > (填序号).__________
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中,水电离出来的c(OH-)=____________.
(4)常温下,将amol/L的醋酸与0.01mol/L的氢氧化钠溶液等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显 _________(填“酸”“碱”“中”)性,用含a的代数式表示CH3COOH的电离平衡常数Ka= ________________ 。
【答案】CO32-+H2O ![]() HCO3-+OH- HCO3-+ H2O
HCO3-+OH- HCO3-+ H2O ![]() H2CO3+OH- c(Na+)>c(CO32-)>C(OH-)>c(HCO3-) >c(H+) ⑤>④>②>③>① 10-8 中性(或“中”) Ka =
H2CO3+OH- c(Na+)>c(CO32-)>C(OH-)>c(HCO3-) >c(H+) ⑤>④>②>③>① 10-8 中性(或“中”) Ka = ![]()
【解析】
(1)①碳酸盐是一种强碱弱酸盐,水解显碱性,②Na2CO3为强碱弱酸盐,CO32水解导致溶液呈碱性且第一步水解大于第二步;
(2)①是弱碱部分电离,存在电离过程;②③④⑤都是铵盐是强电解质完全电离,存在水解过程,依据弱电解质的电离和盐类水解平衡移动的影响因素解答;
(3)pH=6的CH3COOH与CH3COONa的混合溶液中的氢氧根离子是水电离,根据Kw计算水电离的c(OH-);
(4)据电荷守恒进行判断,据电离常数表达式进行计算。
(1)① 碳酸盐是一种强碱弱酸盐,碳酸根离子水解显碱性,使盐碱地显碱性,水解的离子方程式:CO32-+H2O ![]() HCO3-+OH- HCO3-+ H2O
HCO3-+OH- HCO3-+ H2O ![]() H2CO3+OH-
H2CO3+OH-
故答案为:CO32-+H2O ![]() HCO3-+OH- HCO3-+ H2O
HCO3-+OH- HCO3-+ H2O ![]() H2CO3+OH-
H2CO3+OH-
②Na2CO3为强碱弱酸盐,CO32水解导致溶液呈碱性,溶液中的电离和水解有: Na2CO3=2Na++ CO32,CO32+H2OH CO3+OH,HCO3+H2OH2CO3+OH,H2OOH+H+
根据盐的水解程度很小且第一步水解大于第二步可知:溶液中离子浓度大小顺序c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) >c(H+);
(2)假设各种溶液的浓度均为1mol/L,②③④⑤都是铵盐是强电解质完全电离,④⑤电离产生的铵根离子浓度约为2mol/L,④碳酸根离子和铵根离子发生双水解相互促进,所以⑤>④;②③电离产生的铵根离子的浓度约为1mol/L,②中硫酸氢根电离产生的氢离子抑制铵根离子的水解,所以②>③;①是弱电解质只有小部分电离,铵根离子浓度远远小于1mol/L,所以铵根离子浓度由大到小的顺序是:⑤>④>②>③>①,
故答案为:⑤>④>②>③>①;
(3)pH=6的CH3COOH与CH3COONa的混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度,则溶液呈酸性,该混合液中的氢氧根离子是水电离的,则水电离出的c(OH)=Kw/c(H+)=1014/106mol/L=108mol/L,
故答案为:1×108;
(4)由电荷守恒可知,c(Na+)+c(H+)=c(OH)+c(CH3COO),已知溶液中c(CH3COO)═c(Na+),则c(H+)=c(OH),即溶液显中性,呈中性则c(H+)=c(OH)=107mol/L,c(Na+)=c(CH3COO)=0.005mol/L,所以用含a的代数式表示CH3COOH的电离常数Ka=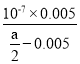 =
=![]() ,
,
故答案为:中;![]()

【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。

(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。


(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。