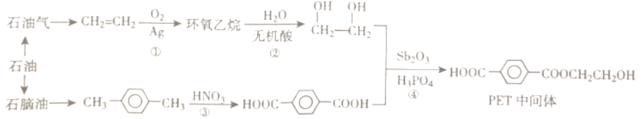
题目内容
【题目】某同学进行影响草酸溶液与高锰酸钾酸性溶液反应速率因素的研究。室温下,实验数据如下:
实验序号 | ① | ② | ③ |
加入试剂 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量MnSO4固体 | 4mL 0.01mol/L KMnO4 2mL 0.1mol/L H2C2O4 少量Na2SO4固体 |
褪色时间/s | 116 | 6 | 117 |
(1)草酸溶液与高锰酸钾酸性溶液反应的离子方程式为___________________。
(2)该实验结论是_______________________。
(3)进行上述三个实验后,该同学进行反思,认为实验①的现象可以证明上述结论。请写出实验①的现象为____________________。
(4)实验②选用MnSO4固体而不是MnCl2固体的原因是_________________。
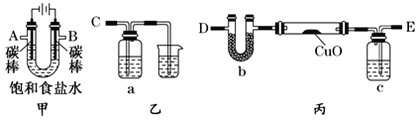
(5)该同学拟采用如下图所示的实验方案继续探究外界条件对反应速率的影响。

a.该同学拟研究的影响因素是___________________。
b.你认为该同学的实验方案_______________(填“合理”或“不合理”),理由是____________________________。
【答案】5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2↑ 在其他条件相同时,Mn2+是草酸与酸性高锰酸钾反应的催化剂,起着加快反应速率的作用 高锰酸钾溶液褪色的速率开始比较缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速率 酸性高锰酸钾溶液具有强氧化性,能氧化氯化锰中的氯离子,同时使酸性高锰酸钾溶液褪色,从而缩短褪色时间,对实验产生干扰 KMnO4溶液的浓度对反应速率的影响 不合理 KMnO4溶液浓度不同,开始反应时溶液的起始颜色深浅不同,无法通过比较褪色的时间长短来判断反应快慢
【解析】
(1)酸性高锰酸钾溶液和草酸反应生成锰离子、二氧化碳,由质量守恒、电荷守恒可知该反应的离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2↑;
(2)实验实验①②③中反应物都是KMnO4和H2C2O4,都在室温下反应,说明浓度相同,温度相同,高锰酸钾褪色最快的是②,加入了硫酸锰,③中加的是硫酸钠与①褪色时间基本相同,对比得知起催化作用的是Mn2+;故答案为:在其他条件相同时,Mn2+是草酸与酸性高锰酸钾反应的催化剂,起着加快反应速率的作用;
(3)实验②是单独加入催化剂MnSO4,而草酸与酸性高锰酸钾反应本身是会生成MnSO4的,那么这个反应的产物就会起到催化剂的作用,所以实验①的现象为:高锰酸钾溶液褪色的速率开始比较缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速率;答案为:高锰酸钾溶液褪色的速率开始比较缓慢,一段时间后突然加快,因为反应生成的MnSO4是草酸与酸性高锰酸钾反应的催化剂,能加快化学反应速率;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化氯化锰中的氯离子,同时使酸性高锰酸钾溶液褪色,从而缩短褪色时间,对实验产生干扰;
(5)a.根据实验方案中KMnO4溶液的浓度不同可知该实验研究的是KMnO4溶液的浓度对反应速率的影响;
b.反应的速率通过KMnO4溶液颜色的变化来判断,但两个实验中KMnO4的浓度不同,开始反应时溶液的起始颜色深浅不同,无法通过比较褪色的时间长短来判断反应快慢,因此该方案不合理;答案为:不合理;KMnO4溶液浓度不同,开始反应时溶液的起始颜色深浅不同,无法通过比较褪色的时间长短来判断反应快慢。

 名校课堂系列答案
名校课堂系列答案【题目】I、实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

(1)不能用铁丝搅拌棒代替环形玻璃搅拌棒的理由是_______
(2)经数据处理,测得中和热为56.8 kJ·mol-1其热化学方程式为:___________
II.实验室制备硝基苯实验装置和步骤如下:(实验步骤)

取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混合均匀,在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18.00 g。请回答:
(1)装置B的名称是________,装置C的作用是________________。
(2)实验室制备硝基苯的化学方程式是____________________________。
(3)为了使反应在50~60 ℃下进行,常用的方法是__________。
(4)在洗涤操作中,第二次水洗的作用是____________________。