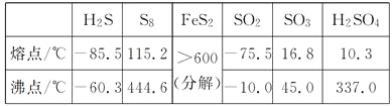
题目内容
【题目】某烧杯中盛有含0.2 mol NH4Al(SO4)2的溶液,向其中缓缓加入4 mol·L-1的NaOH溶液200 mL,使其充分反应,此时烧杯中铝元素的存在形式为( )
A. Al3+和Al(OH)3 B. AlO2— C. AlO2—和Al(OH)3 D. Al(OH)3
【答案】D
【解析】
含有0.2 mol NH4Al(SO4)2的溶液中n(NH4+)=0.2 mol,n(Al3+)=0.2 mol,200 mL4 mol·L-1的NaOH溶液中n(OH-)=4 mol·L-1![]() 0.2L=0.8 mol,首先与Al3+反应生成Al(OH)3,Al3+反应完毕,剩余的OH-再与NH4+反应生成NH3
0.2L=0.8 mol,首先与Al3+反应生成Al(OH)3,Al3+反应完毕,剩余的OH-再与NH4+反应生成NH3![]() H2O,NH4+反应完毕,剩余的OH-再与Al(OH)3反应生成AlO
H2O,NH4+反应完毕,剩余的OH-再与Al(OH)3反应生成AlO![]() 。据此根据方程式,计算判断。
。据此根据方程式,计算判断。
首先:Al3+![]() OH-
OH-
0.2mol 0.6mol
Al3+反应完毕,剩余的OH-为0.8mol-0.6mol=0.2mol。
然后:NH4+![]() OH-
OH-
0.2mol 0.2mol
OH-与NH4+恰好反应,没有OH-剩余,Al(OH)3不溶解。
故铝元素的存在形式为Al(OH)3。
所以D选项是正确的。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
【题目】将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度 | 平衡浓度(mol·L-1) | |
c(NH3) | c(CO2) | |
T1 | 0.1 | |
T2 | 0.1 | |
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)