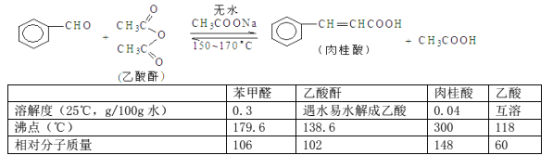
题目内容
【题目】钠、铝、铁是三种重要的金属。请回答:
(1)钠在空气中燃烧,得到的产物化学式为___,它的电子式为___。
(2)将一小块金属钠(2.3g)投入100mL水中,发生反应的离子方程式为__;可观察到的实验现象是__(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(3)向(2)所得溶液中加入5.4g铝单质充分反应,写出反应的化学方程式___,转移电子数目为___。
(4)Fe跟Cl2在一定条件下反应,所得产物的化学式是___。将该产物溶于水配成溶液,分装在两支试管中。请回答:
a.若向其中一支试管中滴加KSCN溶液,则溶液变成__色。
b.向另一支试管中滴加NaOH溶液,现象为___,反应的离子方程式是___。
【答案】Na2O2 ![]() 2Na+2H2O→2Na++2OH-+H2↑ bc 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 0.3NA FeCl3 红 生成红褐色沉淀 Fe3++3OH-=Fe(OH)3↓
2Na+2H2O→2Na++2OH-+H2↑ bc 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 0.3NA FeCl3 红 生成红褐色沉淀 Fe3++3OH-=Fe(OH)3↓
【解析】
(1)钠在空气中燃烧,生成过氧化钠,过氧化钠剩余离子化合物,据此分析解答;
(2)Na可与水反应生成NaOH和H2,结合Na的物理性质判断可能观察到的现象;
(3)铝能与NaOH溶液反应生成偏铝酸钠和氢气,根据氢氧化钠和铝的物质的量计算判断;
(4)Fe和Cl2反应生成FeCl3,结合Fe3+的性质解答该题。
(1)钠在空气中燃烧,生成过氧化钠(Na2O2),电子式为![]() ,故答案为:Na2O2;
,故答案为:Na2O2;![]() ;
;
(2)Na可与水反应生成NaOH和H2,反应的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,由于钠的密度比水小,可观察到钠浮在水面上,并四处游动,因钠的熔点较低,反应放热,则可观察到钠熔成小球,故答案为:2Na+2H2O═2Na++2OH-+H2↑;bc;
(3)铝能与NaOH溶液反应生成偏铝酸钠和氢气,2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑,5.4g铝的物质的量为![]() =0.2mol,氢氧化钠的物质的量=
=0.2mol,氢氧化钠的物质的量=![]() =0.1mol,反应后氢氧化钠完全反应,铝剩余0.1mol,反应中铝由0价变成+3价,转移电子0.3mol,数目为0.3NA,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;0.3NA;
=0.1mol,反应后氢氧化钠完全反应,铝剩余0.1mol,反应中铝由0价变成+3价,转移电子0.3mol,数目为0.3NA,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;0.3NA;
(4)Fe和Cl2反应生成FeCl3,Fe3+与KSCN溶液反应生成血红色溶液,与NaOH溶液溶液反应生成红褐色沉淀Fe(OH)3,Fe3++3OH-═Fe(OH)3↓,故答案为:FeCl3;红(或血红);生成红褐色沉;Fe3++3OH-═Fe(OH)3↓。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】下列有关实验的描述正确的是( )
选项 | 实验内容 | 现象或结论 |
A | 向平衡体系FeCl3+3KSCN | 溶液颜色明显变浅 |
B | 用NaOH溶液滴定盐酸(酚酞作指示剂)至终点 | 溶液由红色变为无色 |
C | 二氧化硫通入到酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色,SO2具有还原性 |
D | 将钠置于一定量的乙醇中 | 钠浮在液面上剧烈反应 |
A.AB.BC.CD.D