题目内容
【题目】硫代硫酸钠可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S=Na2S2O3。常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O35H2O于4045℃熔化,48℃分解:Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线 如图所示。

I.现按如下方法制备Na2S2O35H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按如下图示安装好装置。
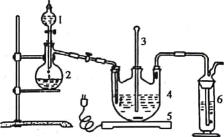
(1)仪器2的名称为__________,装置6中可加入________。
A. BaCl2溶液 B.浓 H2SO4 C.酸性KMnO4溶液 D. NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二 氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2═Na2SO3+CO2 ②Na2S+SO2+H2O═Na2SO3+H2S
③2H2S+SO2═3S↓+2H2O ④Na2SO3+S![]() Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:______(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量:

(3)为减少产品的损失,操作①为_______,操作②是抽滤、洗涤、干燥,其中洗涤操作是用______(填试剂名称)作洗涤剂。
(4)蒸发浓缩滤液,直至溶液呈微黄色浑浊为止。蒸发时要控制温度不宜过高,其原因是_______________。
(5)制得的粗产品中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定杂质与酸性KMnO4溶液不反应)。 称取1.28g粗样品溶于水,用0.40mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液 中S2O32-全部被氧化时,消耗KMnO4溶液20.00mL。(5S2O32-+ 8MnO4-+14H+=8Mn2++l0SO42-+7H2O)
试回答:
①滴定终点时的颜色变化_______________。
②产品中Na2S2O35H2O的质量分数为________________。
【答案】蒸馏烧瓶 CD Na2S2O3在酸性环境中不能稳定存在,S2O32-+2H+=S↓+SO2↑+H2O 趁热过滤 乙醇 温度过高会导致析出的晶体分解 溶液由无色变为浅红色,半分钟内不褪色 96.9%
【解析】
(1)根据仪器2的构造及使用方法写出其名称;根据装置6在实验中的作用选用试剂;
(2)根据酸性条件下硫代硫酸钠与氢离子反应生成二氧化硫和硫单质分析;
(3)操作①的目的是分离出用于吸收有色杂质的活性炭,则该操作为过滤,由于常温下溶液中析出晶体Na2S2O35H2O,为了避免产品损失,需要趁热过滤;Na2S2O3易溶于水,不溶于乙醇,为了减少损失,可以用乙醇为洗涤剂;
(4)根据“Na2S2O35H2O于40~45℃熔化,48℃分解”分析蒸发时要控制温度不宜过高的原因;
(5)①反应结束前溶液为无色,反应结束后溶液中高锰酸根离子过量,溶液变为浅红色;
②根据n=cV计算出1.28g样品消耗的高锰酸钾的物质的量,根据反应计算出样品中含有Na2S2O35H2O的物质的量,再根据质量分数的表达式计算出产品中Na2S2O35H2O的质量分数。
(1)根据图示装置可知,仪器2的名称为蒸馏烧瓶;
装置6是尾气吸收装置主要吸收SO2污染性气体,选项中酸性KMnO4溶液具有氧化性,能氧化SO2生成H2SO4而吸收;NaOH溶液和SO2反应生成Na2SO3和水,也能吸收SO2,而浓硫酸、氯化钡与SO2都不反应,不能吸收SO2,故选项C、D合理;
(2)当溶液pH<7时,溶液显示酸性,会发生反应:S2O32-+2H+=S↓+SO2↑+H2O,所以Na2S2O3在酸性环境中不能稳定存在,溶液的pH应不小于7;
(3)常温下溶液中析出晶体为Na2S2O35H2O,Na2S2O35H2O于40~45℃熔化,为了避免析出Na2S2O35H2O导致产率降低,所以操作①过滤出活性炭时需要趁热;
洗涤晶体时为减少晶体损失,减少Na2S2O35H2O的溶解,依据Na2S2O3易溶于水,不溶于乙醇的性质选择乙醇洗涤,且洗涤后乙醇易挥发,不引入新的杂质,
(4)由于Na2S2O35H2O于40~45℃熔化,48℃分解,所以蒸发时温度过高会导致析出的晶体分解,降低了产率;
(5)①依据标定的原理可知,反应结束前溶液为无色,反应结束后溶液中高锰酸根离子过量,溶液变为浅红色,所以滴定终点的现象为:溶液由无色变为浅红色,半分钟内不褪色;
②20.00mL 0.40mol/L KMnO4溶液中含有高锰酸钾的物质的量为:n(KMnO4)=0.40mol/L×0.02L=0.008mol,根据反应5S2O32-+8MnO4-+14H+═8Mn2++10SO42-+7H2O可知,1.28g的粗样品含有Na2S2O35H2O的物质的量为:n(Na2S2O35H2O)=n(S2O32-)=![]() ×n(KMnO4)=0.005mol,产品中Na2S2O35H2O的质量分数为:
×n(KMnO4)=0.005mol,产品中Na2S2O35H2O的质量分数为:![]() =96.9%。
=96.9%。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】在一定温度下,10 mL 4.0 mol/L H2O2发生分解:2H2O2![]() H2O+ O2
H2O+ O2![]() ,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述正确的是(溶液体积变化忽略不计)
A. 6 min时反应速率υ(H2O2) = 3.33×10-2 mol/(L·mol)
B. 反应到6 min时,H2O2分解率为50%
C. 其他条件不变,若换用更高效的催化剂,达到平衡时将会得到更多氧气
D. 随时间增长得到的氧气更多,说明反应速率逐渐加快







