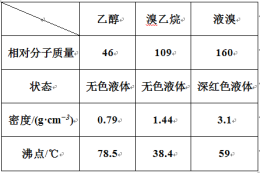
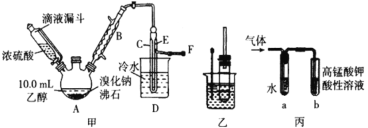
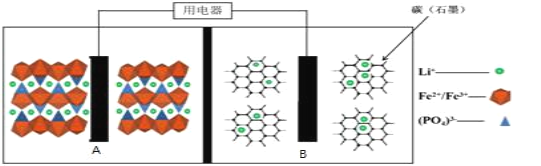
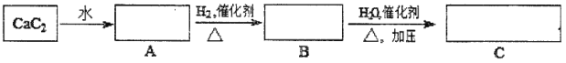
题目内容
【题目】实验室用浓度为0.500mol/L的标准氢氧化钠溶液来测定未知浓度的盐酸。在锥形瓶中放入20.00mL的待测溶液,再滴加2滴酚酞,摇匀。用标准氢氧化钠溶液滴定,直到滴入最后一滴氢氧化钠溶液,指示剂的颜色_______,并在半分钟内溶液颜色不发生变化,停止滴定,记录读数。数据如表:
次数 | 滴定前(mL) | 滴定后(mL) |
1 | 0.40 | 21.10 |
2 | 0.10 |
第2次滴定后滴定管的读数如图所示。根据表中的数据计算出盐酸的浓度为_____mol/L。

【答案】由无色变为浅红色 0.5075
【解析】
用标准氢氧化钠溶液来测定未知浓度的盐酸,用酚酞作指示剂时,溶液颜色由无色变为浅红色且半分钟内不变色,可说明达到滴定终点;滴定管的刻度由上而下刻度增大,精度为0.01mL,据此结合图象读数;求出1、2组平均消耗V(NaOH),根据盐酸和NaOH反应求出c(HCl)。
用标准氢氧化钠溶液来测定未知浓度的盐酸,用酚酞作指示剂时,溶液颜色由无色变为浅红色且半分钟内不变色,可说明达到滴定终点;第2次滴定后滴定管的读数20.00mL,两次滴定消耗氢氧化钠溶液的体积分别为:20.70mL,19.90mL,求出1、2组平均消耗V(NaOH)=20.30mL,由HCl+NaOH=NaCl+H2O得:20.00mL×c(HCl)=20.30mL×0.500mol/L,则c(HCl)=![]() =0.5075mol/L;故答案为:由无色变为浅红色,0.5075。
=0.5075mol/L;故答案为:由无色变为浅红色,0.5075。

 阅读快车系列答案
阅读快车系列答案【题目】下列有关实验的描述正确的是( )
选项 | 实验内容 | 现象或结论 |
A | 向平衡体系FeCl3+3KSCN | 溶液颜色明显变浅 |
B | 用NaOH溶液滴定盐酸(酚酞作指示剂)至终点 | 溶液由红色变为无色 |
C | 二氧化硫通入到酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色,SO2具有还原性 |
D | 将钠置于一定量的乙醇中 | 钠浮在液面上剧烈反应 |
A.AB.BC.CD.D
【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1 h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01molL-1KMnO4溶液,几滴浓H2SO4 | 2 mL0.3molL-1 H2C2O4溶液 | 2 | 褪为无色 |
b | 4mL0.01molL-1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01molL-1K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01molL-1K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:___________。
(2)实验Ⅰ试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为__________。
(3)瑛瑛和超超查阅资料,实验Ⅰ试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验Ⅱ | 实验Ⅲ | 实验Ⅳ | |
实验 操作 |
|
|
|
实验 现象 | 6min后固体完全溶解,溶液橙色变浅,温度不变 | 6min后固体未溶解,溶液颜色无明显变化 | 6min后固体未溶解,溶液颜色无明显变化 |
实验Ⅳ的目的是:_______________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72-浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i:MnO2与H2C2O4反应生成了Mn2+。
过程ii:___________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001mol MnO2加入到6mL______中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到________________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案如下:将2mL、0.3mol/LH2C2O4溶液与4mL0.01mol/LK2Cr2O7溶液混合,调至pH=2,加入0.0001molMnSO4固体,6分钟后现象为:______________
(5)综合以上实验可知,草酸发生氧化反应的速率与____________有关。