题目内容
【题目】根据要求填空:
(1)①常温下,.某溶液中由水电离出的c(OH﹣)=1.0×10﹣10mol/L,该溶液可以是 . (填选项)
A.pH=4的CH3COOH
B.pH=10的NaOH
C.pH=9的 Na2CO3
D.pH=2的 H2SO4
E.pH=4的 NH4Cl
(2)在100℃时,将 100mL 0.1mol/L 的稀H2SO4溶液与 100mL 0.4mol/L的NaOH 溶液混合后,溶液的pH= . (混合时溶液体积变化忽略不计,己知Kw=10﹣12).
(3)常温下,amL0.1mol/L盐酸与bmL0.1mol/L氨水混合,充分反应,若混合后溶液呈中性,则ab (填“<”、“>”或“=”).
(4)常温下,amLpH=3的盐酸与bmLpH=11的氨水混合,充分反应,若a=b,则反应后溶液中离子浓度从大到小的顺序是 .
(5)氯化铝水溶液呈酸性,原因是(用离子方程式表示>: . 把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(6)25℃,在0.10mol/LH2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如下图(忽略溶液体积的变化、H2S的挥发). ①pH=13时,溶液中的 c(H2S)+c(HS﹣)=mol/L.
②某溶液含 0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=时,Mn2+开始沉淀.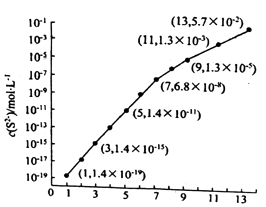
【答案】
(1)AB
(2)11
(3)<
(4)c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+);
(5)Al3++3H2O?Al(OH)3+3H+; Al2O3
(6)0.043;5
【解析】解:(1)A.pH等于4的醋酸溶液中,c(H+)=10﹣4mol/L,对水的电离起到抑制作用,酸溶液中氢氧根离子完全由水电离,水电离出的c (OH﹣)= ![]() =1.0×10﹣10mol/L,故A正确;
=1.0×10﹣10mol/L,故A正确;
B.pH=10的NaOH溶液中,c(H+)=10﹣10mol/L,对水的电离起到抑制作用,碱溶液中氢离子完全由水电离,水电离出的c (OH﹣)=c(H+)=1.0×10﹣10mol/L,故B正确;
C.Na2CO3属于强碱弱酸盐,促进水电离,pH=9的Na2CO3溶液中,c(H+)=10﹣9mol/L,水电离出的c (OH﹣)= ![]() =10﹣5mol/L,故C错误;
=10﹣5mol/L,故C错误;
D.pH=2的硫酸溶液中,c(H+)=10﹣2mol/L,对水的电离起到抑制作用,酸溶液中氢氧根离子完全由水电离,水电离出的c (OH﹣)= ![]() =1.0×10﹣12mol/L,故D错误;
=1.0×10﹣12mol/L,故D错误;
E.NH4Cl属于强酸弱碱盐,促进水电离,pH=4的NH4Cl溶液中,c(H+)=10﹣4mol/L,水电离出的c (OH﹣)=c(H+)=10﹣4mol/L,故E错误;
所以答案是:AB;(2)该温度下,将100mL 0.1molL﹣1的稀H2SO4中n(H+)=cV=0.2mol/L×0.1L=0.02mol,100mL 0.4molL﹣1的NaOH溶液中n(OH﹣)=cV=0.4mol/L×0.1L=0.04mol,混合后,NaOH过量,溶液显碱性,溶液中c(OH﹣)= ![]() =
= ![]() =0.1mol/L,由于水的离子积Kw=c(H+)c(OH﹣)=10﹣12,故c(H+)=10﹣11mol/L,而pH=﹣lgc(H+)=11,
=0.1mol/L,由于水的离子积Kw=c(H+)c(OH﹣)=10﹣12,故c(H+)=10﹣11mol/L,而pH=﹣lgc(H+)=11,
所以答案是:11;(3)根据NH4Cl溶液呈酸性可知,要使混合后呈中性,必须氢氧化钠过量;根据电荷守恒来分析,a<b;
所以答案是:<;(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.若a=b,反应后一水合氨又电离出氢氧根离子,溶液呈碱性,溶液中电荷守恒分析,离子浓度的关系为:c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+);
所以答案是:c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+);(5)氯化铝水溶液呈酸性是因为铝离子水解显酸性;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是水解生成的氢氧化铝分解得到的氧化铝;
所以答案是:Al3++3H2OAl(OH)3+3H+;Al2O3;( 6 ) ①pH=13时,c(S2﹣)=5.7×10﹣2mol/L,在0.10molL﹣1H2S溶液中根据硫守恒c(H2S)+c(HS﹣)+c(S2﹣)=0.10molL﹣1,所以c(H2S)+c(HS﹣)=0.1﹣5.7×10﹣2=0.043mol/L,
所以答案是:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2﹣)= ![]() =
= ![]() mol/L=1.4×10﹣11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
mol/L=1.4×10﹣11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
所以答案是:5.
【考点精析】关于本题考查的弱电解质在水溶液中的电离平衡,需要了解当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能得出正确答案.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案【题目】现有一瓶A和B的混合液,已知它们的性质如表.
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
A | ﹣11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B分离的常用方法是( )
A.蒸馏
B.分液
C.过滤
D.蒸发
【题目】用标准NaOH溶液滴定充满HCl的烧瓶(标况下)做完喷泉实验后得到的稀盐酸,以测定它的准确浓度,请你回答下列问题:
(1)理论计算该盐酸的物质的量浓度为:________________________________。
(2)若用甲基橙作指示剂,达到满定终点时的现象是___________________________。
(3)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第__________种。
①5.00mol·L-1 ②0.500mol·L-1 ③0.0500mol·L-1
(4)若采用上述最合适浓度的标准NaOH溶液满定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=___________________。
(5)在滴定操作过程中,以下各项操作使测定值偏高的有:_______________
①滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定前平视,滴定终了俯视
④看到颜色变化后立即读数
⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤