题目内容
【题目】根据要求回答问题:
(1)相同温度下等物浓度的下列溶液中. A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是(用对应的字母填写).
②NH4+离子浓度由大到小的顺序是(用对应的字母填写).
③若上述溶液的pH值相同,则其物成的量浓度关系是(用对应的字母填写).
(2)25℃.向50mL 0.018molL﹣1 的 AgNO3溶液中加入50mL 0.020molL﹣1的盐酸,生成沉淀.己知该温度下AgCl的Ksp=1.0×10﹣10 , 忽略溶液的体积变化,请计算: ①完全沉淀后,溶液中c(Ag+)= .
②完全沉淀后,溶液的pH= .
(3)弱酸及其盐在水中存在多种平衡关系.己知NaA水溶液呈碱性,常温下将0.1molNaA和0.05molHCl溶于水,得到1L溶液. ①己知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为 .
②向该混合物中再加0.03molNaOH,溶液中n(A﹣)+n(OH﹣)﹣n(H+)= .
【答案】
(1)B>A>D>C; D>C>A>B; C<D<A<B
(2)1.0×10﹣7mol/L;2
(3)c(Na+)>c(A﹣)>c(Cl﹣)>c(H+)>c(OH﹣);0.08
【解析】解:A.铵根离子水解,溶液呈酸性,B.碳酸氢根离子促进铵根离子水解,酸性较氯化铵溶液酸性弱,C.电离出氢离子,并抑制铵根离子水解,显强酸性,D.铵根离子水解,水解程度不大,铵根离子浓度最大,酸性比氯化铵溶液的酸性强.
①pH值由大到小的顺序是:B>A>D>C,所以答案是:B>A>D>C;
②NH4+离子浓度由大到小的顺序是:D>C>A>B,所以答案是:D>C>A>B;
③相同温度下,相同物质的量浓度的上述溶液pH值由大到小的顺序是:B>A>D>C,若上述溶液的pH值相同,则其物成的量浓度关系应是C<D<A<B,所以答案是:C<D<A<B;(2)①向50ml0.018mol/L的AgNO3溶液中加入50ml0.02mol/L的盐酸,混合后两者浓度分别为c(Ag+)= ![]() mol/L=0.009 mol/L、c(Cl﹣)=
mol/L=0.009 mol/L、c(Cl﹣)= ![]() mol/L=0.01mol/L,Ag+与Cl﹣是等物质的量反应的,此时Cl﹣过量,过量浓度c(Cl﹣)=0.01mol/L﹣0.009mol/L=0.001mol/L,
mol/L=0.01mol/L,Ag+与Cl﹣是等物质的量反应的,此时Cl﹣过量,过量浓度c(Cl﹣)=0.01mol/L﹣0.009mol/L=0.001mol/L,
Ksp=c(Ag+)×C(Cl﹣)=1.0×10﹣10,则:c(Ag+)= ![]() mol/L=1.0×10﹣7mol/L,
mol/L=1.0×10﹣7mol/L,
所以答案是:1.0×10﹣7mol/L;
②沉淀生成后,氢离子浓度c= ![]() =0.01mol/L,所以pH=2,
=0.01mol/L,所以pH=2,
所以答案是:2;(3)①常温下将0.10mol NaA和0.05mol HCl溶于水,得到1L溶液,得到的溶液中含有0.05molNaA、0.05molHA、0.05molNaCl;溶液的pH<7,说明溶液呈酸性,同浓度溶液中HA电离大于A﹣离子的水解,c(A﹣)>c(Cl﹣)、c(H+)>c(OH﹣),则溶液中离子浓度大小为:c(Na+)>c(A﹣)>c(Cl﹣)>c(H+)>c(OH﹣),
所以答案是:c(Na+)>c(A﹣)>c(Cl﹣)>c(H+)>c(OH﹣);
②根据混合液中电荷守恒可得:n(A﹣)+n(OH﹣)+c(Cl﹣)=c(Na+)+n(H+),则n(A﹣)+n(OH﹣)﹣n(H+)=c(Na+)﹣c(Cl﹣)=0.03mol+0.10nol﹣0.05mol=0.08mol,
所以答案是:0.08.
【考点精析】通过灵活运用弱电解质在水溶液中的电离平衡,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理即可以解答此题.

【题目】工业上用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体(K2Cr2O7)和铁红的流程如下:
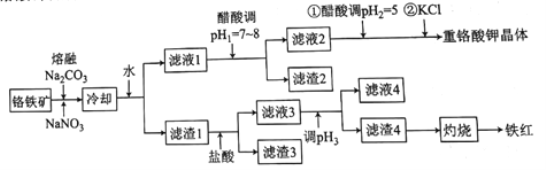
已知:I.常见离子开始生成沉淀和沉淀完全的pH如下表所示:
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀的pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全的pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
II.熔融Na2CO3条件下主要发生反应:
2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
(1)熔融Na2CO3条件下还可以得到的副产物为NaAlO2和Na2SiO3,生成这两种副产物的化学方程式为___________________。
(2)滤渣2的主要成分为________(填化学式)。
(3)用醋酸调节pH2=5的目的为__________;若调节的pH过低,NO2-可被氧化为NO3-,其离子方程式为______________。
(4)调节pH2后,加入KCl控制一定条件,可析出K2Cr2O7晶体的可能理由是_______。
(5)调节pH3的范围为______。
(6)检验滤液4中Fe3+是否沉淀完全的方法是____________。