题目内容
【题目】一定温度下,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应为:2SO2(g)+O2(g) ![]() 2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
A.反应在前2 s的平均速率υ(O2)=0.4 mol·L1·s1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2) 增大
【答案】D
【解析】
A、根据表格中数据知,SO3在反应前2s的平均速率υ (SO3)=![]() =
=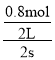 =0.2mol·L1·s1,同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,υ(O2)=
=0.2mol·L1·s1,同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,υ(O2)=![]() ×0.2 mol·L1·s1=0.1 mol·L1·s1,故A错误;
×0.2 mol·L1·s1=0.1 mol·L1·s1,故A错误;
B、化学平衡常数只与温度有关,温度不变,化学平衡常数不变,与压强、物质浓度都无关,故B错误;
C、相同温度下,起始时向容器中充入4molSO3,如果SO3完全转化为SO2和O2,SO2和O2的物质的量分别是4mol、2mol,为原来的2倍。现充入4molSO3,相当于增大压强,平衡正向移动,则SO2转化率增大,所以SO2转化率大于90%,相同温度下,起始时向容器中充入4molSO3,达到平衡时,SO3的转化率小于10%,故C错误;
D、温度不变,向该容器中再充入2molSO2、1molO2,可通过建模![]() 1容器为原平衡,将2molSO2、1molO2加入到2容器内,起始保持压强与1容器内一致,2容器内反应平衡与1完全等效,此时抽出中间隔板,将2压缩至1内,增大了压强,平衡正向移动,SO3的总物质的量增加,O2的总物质的量减小,所以比值增大,故D正确。
1容器为原平衡,将2molSO2、1molO2加入到2容器内,起始保持压强与1容器内一致,2容器内反应平衡与1完全等效,此时抽出中间隔板,将2压缩至1内,增大了压强,平衡正向移动,SO3的总物质的量增加,O2的总物质的量减小,所以比值增大,故D正确。

 名校课堂系列答案
名校课堂系列答案【题目】(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g)2NH3(g)
①在反应体系中加入催化剂,反应速率______,该反应的反应热_______(填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=_________,H2的转化率为______(保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是________。
A.把气体的体积压缩至1L B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(g)4NH3(g)+3O2(g) H=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)


