题目内容
【题目】近期我国学者研制出低成本的电解“水制氢”催化剂——镍掺杂的磷化钴三元纳米片电催化剂(![]() )。回答下列问题:
)。回答下列问题:
(1)Co在元素周期表中的位置为_________,Co2+价层电子排布式为______________。
(2)Co、Ni可形成![]() 、
、![]() 、
、![]() 等多种配合物。
等多种配合物。
①![]() 的空间构型为__________,
的空间构型为__________,![]() 中N原子的杂化轨道类型为_________。
中N原子的杂化轨道类型为_________。
②C、N、O、S四种元素中,第一电离能最大的是_____________。
③![]() 中含有σ键的数目为__________;已知NF3比NH3的沸点小得多,试解释原因________________________________________。
中含有σ键的数目为__________;已知NF3比NH3的沸点小得多,试解释原因________________________________________。
(3)常用丁二酮肟来检验Ni2+,反应如下:
Ni2+(aq)+2 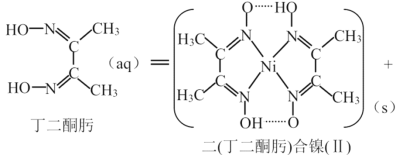 2H+(aq)
2H+(aq)
①1个二(丁二酮肟)合镍(Ⅱ)中含有_________________个配位键。
②上述反应的适宜![]() 为_________________(填字母序号)
为_________________(填字母序号)
A.12 B.5~10 C.1
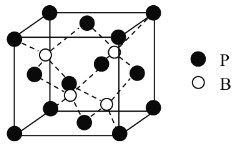
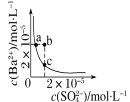
(4)磷化硼是一种备受关注的耐磨涂料,其晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中(如图)。已知磷化硼晶体密度为![]() ,计算晶体中硼原子和磷原子的最近核间距为___________
,计算晶体中硼原子和磷原子的最近核间距为___________![]() 。
。
【答案】第四周期第Ⅷ族 3d7 正四面体形 sp2 N 24NA NH3分子间存在氢键 4 B 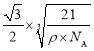
【解析】
(1)Co为27号元素,位于元素周期表第四周期第Ⅷ族;基态Co原子价层电子排布为3d74s2,失去最外层2个电子形成Co2+,所以Co2+的价层电子排布为3d7;
(2)①硫酸根中心原子的价层电子对数为![]() ,无孤对电子,所以空间构型为正四面体结构;NO3-中心原子的价层电子对数为
,无孤对电子,所以空间构型为正四面体结构;NO3-中心原子的价层电子对数为![]() ,所以为sp2杂化;
,所以为sp2杂化;
②同主族元素自上而下第一电离能逐渐减小,同周期元素自左向右第一电离能呈增大趋势,但第I IA族、第VA族元素第一电离能大于其相邻元素,所以4中元素中第一电离能最大的为N元素;
③6个NH3与Co2+之间形成6个配位键,属于σ键,每个氨气分子中的氮氢键也为σ键,共6+3×6=24,所以1mol[Co(NH3)6]Cl2含有的σ键个数为24NA;N元素电负性较大,所以NH3分子间存在氢键,沸点较高;
(3)①根据N原子的成键特点可知,在二(丁二酮肟)合镍中N原子和Ni2+形成的化学键均为配位键,所以1个二(丁二酮肟)合镍中含有4个配位键;
②碱性太强容易生成Ni(OH)2沉淀,酸性太强大量的氢离子存在不利于二(丁二酮肟)合镍的生成,所以适宜的pH应为B:5~10;
(4)由图可知,1个晶胞中含有4个B原子和4个P原子,故晶胞质量![]() ,设边长为acm,则晶胞的体积V=a3cm3,故晶胞密度
,设边长为acm,则晶胞的体积V=a3cm3,故晶胞密度![]() ,解得
,解得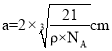 ;晶体中硼原子和磷原子的最近核间距为品胞体对角线的
;晶体中硼原子和磷原子的最近核间距为品胞体对角线的![]() ,体对角线长度为晶胞边长的
,体对角线长度为晶胞边长的![]() 倍,所以晶体中硼原子和磷原子的最近核间距
倍,所以晶体中硼原子和磷原子的最近核间距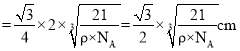 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案