题目内容
4.以葡萄糖为燃料的微生物燃料电池结构如图所示.关于该电池的叙述正确的是( )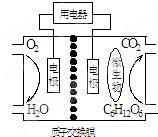
| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| C. | 放电过程中,H+从正极区向负极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下气体$\frac{2.42}{6}$L |
分析 该原电池中,放电时,负极上葡萄糖失电子发生氧化反应,正极上氧气得电子发生还原反应,电解质溶液呈酸性,负极反应式为C6H12O6+6H2O-24e-=6CO2↑+24H+,正极反应式为O2+4e-+4H+═2H2O,电解质溶液中氢离子向正极移动,结合氧气和生成二氧化碳之间的关系式计算.
解答 解:A.高温条件下微生物会变性,该电池不能够在高温下工作,故A错误;
B.负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+,故B正确;
C.放电时,阳离子向正极移动,所以氢离子向正极移动,故C错误;
D.正极反应式为O2+4e-+4H+═2H2O,对比负极反应可知,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,故D错误;
故选B.
点评 本题考查化学电源新型电池,为高考高频点,正确书写正负极电极反应式是解本题关键,注意电解质溶液中阴阳离子移动方向,易错选项是A,注意蛋白质的性质.

练习册系列答案
相关题目
15.下列叙述中正确的是( )
| A. | 糖类不一定都是高分子化合物,但水解产物相同 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,证明甲苯分子中存在单双键交替的结构 | |
| C. | 利用粮食酿酒经过了由淀粉→葡萄糖→乙醇的化学变化过程 | |
| D. | 甲醇、乙二醇(HOCH2CH2OH)互为同系物 |
12.下列反应的离子方程式正确的是( )
| A. | 向明矾溶液中加入足量的烧碱溶液:Al3++3OH-=Al(OH)3↓ | |
| B. | 在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| C. | 碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 纯碱溶液呈碱性的原因:CO32-+H2O?HCO3-+OH- |
16.下列表示对应化学反应的离子方程式.其中正确的是( )
| A. | 向NaAlO2溶液中通入足量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | (NH4)2Fe(SO4)2溶液中加入少量氢氧化钡溶液:NH4++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 工业上用氨水吸收二氧化硫:2NH3.H2O+SO2═2NH4++SO32- | |
| D. | 磁性氧化铁溶于稀硝酸3Fe2++4H++NO3-═3Fe3++NO↑+2H2 |
13.某水体溶有Ca2+、Mg2+、HCO3-三种离子,可先加足量消石灰,再加足量纯碱以除去Ca2+、Mg2+,以下离子方程式肯定不符合反应事实的是( )
| A. | Mg 2++2HC03-+Ca 2++2OH -→MgC03↓+CaC03↓+2H20 | |
| B. | Mg 2++2HC03-+2Ca 2++4OH -→Mg(OH)2↓+2CaC03↓+2H20 | |
| C. | Mg 2++3HC03-+3Ca 2++5OH -→Mg(OH)2↓+3CaC03↓+3H20 | |
| D. | Ca2++C032-→CaCO3↓ |
14.下列说法正确的是( )
| A. | 直径为20nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步均为氧化还原反应 | |
| C. | 可溶性铁盐和铝盐可用作净水剂 | |
| D. | 光导纤维是一种新型硅酸盐材料 |
 Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题:
Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需要.天然气水合物是种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O他子.根据上述信息,完成下面两题: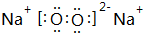 ;
;
 .
. .
.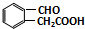 或
或 (任写一种).
(任写一种).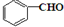 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .
.