题目内容
8.下列离子能大量共存的是( )| A. | CH3COO-、H+、Na+、K+ | B. | NH4+、OH-、Ba2+、Cl- | ||
| C. | Ca2+、NO3-、Ba2+、K+ | D. | NO3-、Ba2+、H+、Fe2+ |
分析 A.醋酸根离子与氢离子结合生成醋酸;
B.铵根离子与氢氧根离子反应生成一水合氨;
C.四种离子之间不发生反应,能够大量共存;
D.硝酸根离子在酸性条件下能够氧化亚铁离子.
解答 解:A.CH3COO-、H+之间反应生成弱电解质醋酸,在溶液中不能大量共存,故A错误;
B.NH4+、OH-之间反应生成弱电解质一水合氨,在溶液中不能大量共存,故B错误;
C.Ca2+、NO3-、Ba2+、K+之间不反应,在溶液中可以大量共存,故C正确;
D.NO3-、H+、Fe2+之间发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列物质中,可一次性鉴别乙酸、乙醇、苯及氢氧化钡溶液的是( )
| A. | 金属钠 | B. | 溴水 | C. | 碳酸钠溶液 | D. | 新制Cu(OH)2悬浊液 |
16.某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到下表的数据:
回答下列问题:
(1)NaHCO3溶于水显碱性,其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解是(填“是”或“否”).
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{84b}{31a}$×100%(用含a、b的代数式表示)附表:溶解度表
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到下表的数据:
| 温度 试剂 | T1/℃ | T2/℃ | T3/℃ |
| NaCO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)NaHCO3溶于水显碱性,其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解是(填“是”或“否”).
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{84b}{31a}$×100%(用含a、b的代数式表示)附表:溶解度表
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
3.对反应 4NH3+5O2═4NO+6H2O,下列反应速率的最快的是( )
| A. | v(NH3)=0.25 mol•L-1•min-1 | B. | v(O2)=0.35mol•L-1•min-1 | ||
| C. | v(NO)=0.01 mol•L-1•s-1 | D. | v(H2O)=0.3 mol•L-1•min-1 |
13.下列说法错误的是( )


| A. | 如图表示化学反应过程中释放能量 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 化学反应中一定存在化学键的变化 | |
| D. | 原电池是将化学能转变成电能的装置 |
20.由-CH3、-OH、 、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
 、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
18.下列装置所示的实验不能达到目的是( )
| A. | 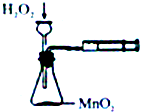 定量测定化学反应速率 | B. | 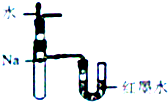 验证Na和水反应的热效应 | ||
| C. |  比较KMnO4、cl2、S的氧化性 | D. | 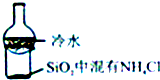 加热烧杯,分离SiO2和NH4Cl |
 和
和 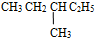 ⑤
⑤ 和
和
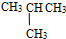 ⑦C2H5OH和C4H9OH
⑦C2H5OH和C4H9OH