题目内容
7.如图是一些常见元素的单质或化合物之间的转化关系.溶液中的水以及部分反应物或生成物未标出.A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,且和SiC具有相同的价电子数和原子数,D是一种单质,F为气体,J是一种能引起温室效应的气体,K是两性化合物.反应③、④、⑤用于工业中生产H.回答下列问题: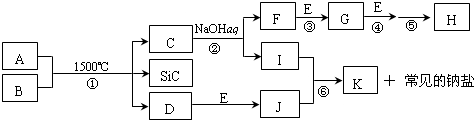
(1)写出下列物质的化学式:FNH3,INaAlO2
(2)写出反应③的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)写出反应⑥的离子方程式:CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-;
(4)B和SiC的纳米级复合粉末是新一代大规模集成电路理想的散热材料.反应①是科学家研究开发制备该纳米级复合粉末的最新途径.已知B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1:4,写出反应①的化学方程式:Al4SiC4+2N2$\frac{\underline{\;1500℃\;}}{\;}$4AlN+SiC+3C.
分析 J是一种能引起温室效应的气体,则J为CO2,A、E是空气中的两种主要成分,D是一种单质,D和E反应生成J,则E为O2,D为C,A为N2,B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1:4,根据元素守恒可知,B为Al4SiC4,C是由两种元素组成的新型材料,且和SiC具有相同的价电子数和原子数,则最外层电子数之和为8,且含有2个原子,应为AlN,与NaOH反应生成F和I,应分别为NH3和NaAlO2,F为气体,则F为NH3,I为NaAlO2,K是两性化合物,K为Al(OH)3,由转化关系可知G为NO,反应③、④、⑤用于工业中生产H,应为氨的催化氧化,工业制硝酸的反应,所以H为HNO3,据此答题.
解答 解:J是一种能引起温室效应的气体,则J为CO2,A、E是空气中的两种主要成分,D是一种单质,D和E反应生成J,则E为O2,D为C,A为N2,B由Si及另外两种元素组成,且Si与另外两种元素的物质的量之比均为1:4,根据元素守恒可知,B为Al4SiC4,C是由两种元素组成的新型材料,且和SiC具有相同的价电子数和原子数,则最外层电子数之和为8,且含有2个原子,应为AlN,与NaOH反应生成F和I,应分别为NH3和NaAlO2,F为气体,则F为NH3,I为NaAlO2,K是两性化合物,K为Al(OH)3,由转化关系可知G为NO,反应③、④、⑤用于工业中生产H,应为氨的催化氧化,工业制硝酸的反应,所以H为HNO3,
(1)由上面的分析可知,F为NH3,I为NaAlO2,
故答案为:NH3;NaAlO2;
(2)反应③为氨气的催化氧化反应,反应的方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)反应⑥为二氧化碳与偏铝酸钠的反应,反应的离子方程式为CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-,
故答案为:CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-;
(4)A中含有Al、Si、C等元素,Si与另外两种元素的物质的量之比均为1:4,应为Al4SiC4,与氮气反应生成AlN、SiC和C,
反应的方程式为Al4SiC4+2N2$\frac{\underline{\;1500℃\;}}{\;}$4AlN+SiC+3C,
故答案为:Al4SiC4+2N2$\frac{\underline{\;1500℃\;}}{\;}$4AlN+SiC+3C.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,本题注意以B为解答该题的突破口,把握题给信息,难度中等.

| A. | 金属钠 | B. | 溴水 | C. | 碳酸钠溶液 | D. | 新制Cu(OH)2悬浊液 |
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
 .
.(2)元素Y与氢元素形成一种离子,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+.
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式:Al(OH)3+OH-═AlO2-+2H2O.
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示),下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)探寻物质的性质差异性是学习的重要方法之一.X、Y、Z三种元素的单质中化学性质明显不同于其他两种单质的是Al(用元素符号表示),理由Al为金属单质,其余为非金属单质.
 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A. | 正极反应式:Ca+2Cl--2e-═CaCl2 | |
| B. | 放电过程中,Li+向负极移动 | |
| C. | 每转移0.1 mol电子,理论上生成20.7 g Pb | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
| A. | C6H14 | B. | C7H16 | C. | C8H18 | D. | C9H20 |
Ⅰ.分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到下表的数据:
| 温度 试剂 | T1/℃ | T2/℃ | T3/℃ |
| NaCO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
(1)NaHCO3溶于水显碱性,其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解是(填“是”或“否”).
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.
乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{84b}{31a}$×100%(用含a、b的代数式表示)附表:溶解度表
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
 ,它的分子式是C10H22
,它的分子式是C10H22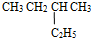 和
和 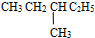 ⑤
⑤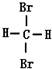 和
和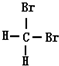
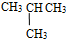 ⑦C2H5OH和C4H9OH
⑦C2H5OH和C4H9OH