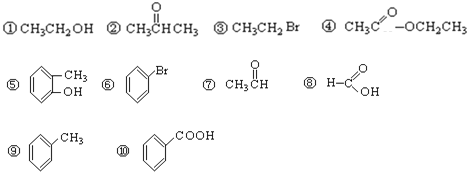
��Ŀ����
����Ŀ��A��B��C����ǿ����ʣ�������ˮ�е�������������±���ʾ��
������ | Na����K����Cu2�� |
������ | SO��OH�� |
����ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��������A��Һ��������B��Һ��������C��Һ���缫��Ϊʯī�缫��
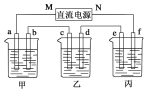
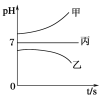
��ͨ��Դ������һ��ʱ�������ձ���c�缫����������16 g�������¸��ձ�����Һ��pH����ʱ��t�Ĺ�ϵ����ͼ���ݴ˻ش��������⣺
��1��MΪ��Դ��_____��(���������)���缫b�Ϸ����ĵ缫��ӦΪ__________________��
��2���缫e�����ɵ������ڱ�״̬�µ����Ϊ________��
��3��д�����ձ��еĵ��ط�Ӧ_______________________��
��4��Ҫʹ���ձ��е�C��Һ�ָ���ԭ����״̬����ȷ�IJ���__________�������������ݣ���
���𰸡���1���� 4OH����4e��===2H2O��O2�� ��2��5.6 L
��3��2CuSO4��2H2O![]() 2Cu��O2����2H2SO4
2Cu��O2����2H2SO4
��4������ձ��м���4.5 gˮ
��������
�����������ͨ��Դ������һ��ʱ��������c�缫����������16g������ӦΪCuSO4��Һ��cΪ������dΪ��������aΪ������bΪ������eΪ������fΪ������MΪ������NΪ�����������¸��ձ�����Һ��pH����ʱ��t�Ĺ�ϵͼ��ͼ2����pH��������ӦΪ�������ƻ�����������Һ������pH���䣬ӦΪ�����ƻ��������Һ����1�������Ϸ�����֪MΪ��������Ϊ����������ƻ�����������Һ��bΪ����������������Ӧ���缫����ʽΪ4OH����4e��=2H2O+O2������2��n��Cu��=![]() =0.25mol��ת�Ƶ���0.5mol����缫e������2H++2e��=H2����������n��H2��=0.25mol��v��H2��=0.25mol��22.4L/mol=5.6L��
=0.25mol��ת�Ƶ���0.5mol����缫e������2H++2e��=H2����������n��H2��=0.25mol��v��H2��=0.25mol��22.4L/mol=5.6L��
��3����ӦΪCuSO4��Һ�����ʱ����������ͭ������������������ⷽ��ʽΪ2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4����4����Ϊ�����ƻ��������Һ��ʵ����Ϊ���ˮ��ת�Ƶ���0.5molʱ��2H2O
2Cu+O2��+2H2SO4����4����Ϊ�����ƻ��������Һ��ʵ����Ϊ���ˮ��ת�Ƶ���0.5molʱ��2H2O![]() 2H2��+O2��������ˮ�����ʵ���Ϊ0.25mol������Ϊ0.25mol��18g/mol=4.5g���ʴ�Ϊ��ˮ��4.5��
2H2��+O2��������ˮ�����ʵ���Ϊ0.25mol������Ϊ0.25mol��18g/mol=4.5g���ʴ�Ϊ��ˮ��4.5��