��Ŀ����
����Ŀ�����������ס������������������ص�Ԫ�ء��ش��������⣺
��1��P�Ļ�̬ԭ��������Ӳ���е�ԭ�ӹ����Ϊ ��Fe3+��Fe2+�ȶ���ԭ���� ��
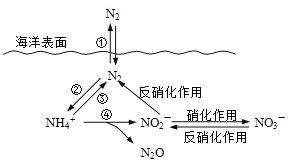
��2��N��O��P����Ԫ�ص�һ������������ ���縺�������� ��
��3������������NH4SCN��Һ�Ǽ���Fe3+�ij����Լ���SCN-��Cԭ�ӵ��ӻ�����Ϊ ��1mol SCN-�к���������ĿΪ NA��
��4��ijֱ���������Ƶ������ӳ���ͼ��ʾ��������״�ṹ����������������ͨ�����ж�����ԭ����������ö������ƵĻ�ѧʽΪ ��
![]()
��5��FeO��NiO�ľ���ṹ�����Ȼ��ƾ���ṹ��ͬ������Fe2+��Ni2+�����Ӱ뾶�ֱ�Ϊ7.8��10-2nm��6.9��10-2nm�����۵�FeO NiO�����������������=����ԭ���� ��
��6��������һ�ֳ�Ӳ��ĥ��Ϳ����ϣ��侧���ṹ��ͼ��ʾ��Pԭ����Bԭ�ӵ��������Ϊacm���������ı߳�Ϊ cm�����ú�a�Ĵ���ʽ��ʾ��

���𰸡���1��9�� Fe3���ļ۵��ӵ��Ų�Ϊ3d5�����ڰ�������ṹ�ȶ���
��2��N�� O��
��3��sp�� 2��
��4��NaPO3��(NaPO3)n��
��5������ FeO��NiO��ȣ���������ͬ�����������������ͬ����Fe2+�뾶����Ni2+�뾶������FeO�ľ�����С���۵�͡�
��6��![]()
��������
�����������1��P�ǵ�������Ԫ�أ�����P�Ļ�̬ԭ��������Ӳ���е�ԭ�ӹ����Ϊ32=9��Ϊ26��Ԫ�أ�������Ų�ʽΪ��[Ar]3d64s2��Fe3���ļ۵��ӵ��Ų�Ϊ3d5�����ڰ�������ṹ�ȶ�������Fe3+��Fe2+�ȶ����ʴ�Ϊ��9�� Fe3���ļ۵��ӵ��Ų�Ϊ3d5�����ڰ�������ṹ�ȶ���
��2��N��O��P����Ԫ��������NԪ�����۵��ӵ��Ų�Ϊ2s22p3�����ڰ�������ṹ�ȶ���������һ������������NԪ�أ�Ԫ�صķǽ�����Խǿ�����縺��Խ�������縺��������OԪ�ء�
�ʴ�Ϊ��N��O��
��3��HSCN�ĽṹʽΪ��H-S-C��N������SCN-��Cԭ�ӵ��ӻ�����Ϊsp�ӻ���һ��SCN-������C��Nԭ�Ӽ京��1��������2������������1mol SCN-�к��м�����ĿΪ2NA��
�ʴ�Ϊ��sp��2��
��4������ֱ���������Ƶ���������������״�ṹ����������������ͨ�����ж�����ԭ����������֪P��Oԭ�Ӹ�����Ϊ1��3�����ݻ��ϼ۴�����Ϊ0��֪����������P��O��Naԭ�Ӹ�����Ϊ1��3��1�����ԣ��ö������ƵĻ�ѧʽΪNaPO3��(NaPO3)n��
�ʴ�Ϊ��NaPO3��(NaPO3)n��
��5��������֪FeO��NiO�ľ���ṹ�����Ȼ��ƾ���ṹ��ͬ�������Ӿ��壬FeO��NiO��ȣ���������ͬ�����������������ͬ����Fe2+�뾶����Ni2+�뾶������FeO�ľ�����С���۵�͡�
�ʴ�Ϊ������FeO��NiO��ȣ���������ͬ�����������������ͬ����Fe2+�뾶����Ni2+�뾶������FeO�ľ�����С���۵�͡�
��6�����ݾ����ṹ��֪��Pԭ������Bԭ�����ɵ��������������λ�ã���Pԭ����Bԭ�ӵ��������Ϊacm��Pԭ�ӵ���������������Ϊ![]() cm���������ı߳�Ϊ
cm���������ı߳�Ϊ![]() cm��
cm��
�ʴ�Ϊ��![]() ��
��

 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�����Ŀ��A��B��C����ǿ����ʣ�������ˮ�е�������������±���ʾ��
������ | Na����K����Cu2�� |
������ | SO��OH�� |
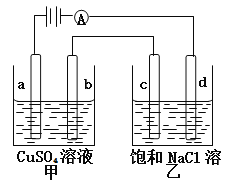
����ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��������A��Һ��������B��Һ��������C��Һ���缫��Ϊʯī�缫��

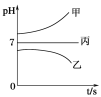
��ͨ��Դ������һ��ʱ�������ձ���c�缫����������16 g�������¸��ձ�����Һ��pH����ʱ��t�Ĺ�ϵ����ͼ���ݴ˻ش��������⣺
��1��MΪ��Դ��_____��(���������)���缫b�Ϸ����ĵ缫��ӦΪ__________________��
��2���缫e�����ɵ������ڱ�״̬�µ����Ϊ________��
��3��д�����ձ��еĵ��ط�Ӧ_______________________��
��4��Ҫʹ���ձ��е�C��Һ�ָ���ԭ����״̬����ȷ�IJ���__________�������������ݣ���