题目内容
12.航天飞船可用肼(电子式为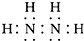 )作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )
)作动力源.已知1g液态肼和足量的液态过氧化氢(结构式为H-O-O-H)反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O.下列说法中错误的是( )| A. | 该动力源的突出优点之一是反应产物对环境无污染 | |
| B. | 液态肼燃烧生成1 mol N2时放出的热量为20.05 kJ | |
| C. | 该反应中肼作氧化剂 | |
| D. | 肼和过氧化氢中的化学键类型相同 |
分析 A、根据反应产物分析;
B、液态肼燃烧时与氧气反应.
C、N2H4失电子,H2O2得电子;
D、肼中含有的N-N、N-H键以及过氧化氢中含有O-H、O-O键.
解答 解:A、液态肼和液态过氧化氢反应生成氮气和水蒸气,对环境无污染,故A正确;
B、1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量,液态肼燃烧是与氧气反应,所以无法计算液态肼燃烧生成1 mol N2时放出的热量,故B错误.
C、N2H4失电子,作还原剂,H2O2得电子,作氧化剂,故C错误;
D、肼中含有的N-N、N-H键,分别为非极性键和极性键,过氧化氢中含有O-O、O-H键,分别为非极性键和极性键,所以肼和过氧化氢中的化学键类型相同,故D正确.
故选BC.
点评 本题将热化学方程式的知识、氧化还原、环境污染、化学键等知识结合起来,综合性较强,侧重于基础知识的综合应用的考查,题目难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
2.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,下列判断正确的是( )
| A. | 原子半径:A>B>C>D | |
| B. | 元素金属性:B>A,元素非金属性:D>C | |
| C. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| D. | 原子序数:b>a>c>d |
3.一种氢氧燃料电池的电解液为KOH溶液.下列有关该电池的叙述不正确的是( )
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解液中KOH的物质的量不变 | |
| C. | 该燃料电池的总反应方程式为:2H2+O2═2H2O | |
| D. | H2通入的一极为正极 |
20.下列气体最易溶于水的是( )
| A. | 氨气 | B. | 氯气 | C. | 二氧化硫 | D. | 氯化氢 |
7.2011年3月,日本因发生9.0级特大地震而导致核电站的放射性物质严重泄漏.放射性物质主要包括${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs,${\;}_{53}^{131}$I可能会引发甲状腺疾病,${\;}_{55}^{137}$Cs则会造成人体造血系统和神经系统损伤.下列关于${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs的说法错误的是( )
| A. | ${\;}_{53}^{127}$I、${\;}_{53}^{131}$I、${\;}_{55}^{134}$Cs、${\;}_{55}^{137}$Cs是四种核素,两组同位素 | |
| B. | ${\;}_{53}^{131}$I和${\;}_{55}^{137}$Cs的中子数分别是78、82 | |
| C. | 在周期表中Cs与I位于同一周期 | |
| D. | 铯与碘能化合生成CsI |
4.下列各组原子中,彼此化学性质一定相似的是( )
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式的1s22s2的Y原子 | |
| B. | 原子核外L层仅有两个电子的X原子与原子核外M层仅有两个电子的Y原子 | |
| C. | 2p轨道只有一个未成对电子的X原子和3P轨道只有一个未成对电子的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
1.下列措施对增大反应速率明显有效的是( )
| A. | Na与水反应时增大水的用量 | |
| B. | CaCO3与盐酸反应制取CO2时,改用浓硫酸 | |
| C. | C(s)+H2O(g)?CO(g)+H2(g),将碳块改成碳粉进行实验 | |
| D. | 粗锌与盐酸反应,将粗锌换成纯锌 |
2.有4种有机物:
①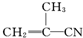 ②
②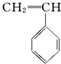 ③
③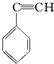 ④CH3-CH═CH-CN,其中可用于合成结构简式为
④CH3-CH═CH-CN,其中可用于合成结构简式为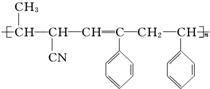 的高分子材料的正确的组合为( )
的高分子材料的正确的组合为( )
①
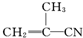 ②
② ③
③ ④CH3-CH═CH-CN,其中可用于合成结构简式为
④CH3-CH═CH-CN,其中可用于合成结构简式为 的高分子材料的正确的组合为( )
的高分子材料的正确的组合为( )| A. | ①③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |