题目内容
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混台后所得溶液
的pH如下表: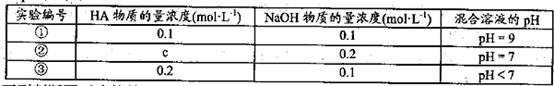
下列判断不正确的是
A.HA的电离方程式为: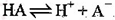 |
B.不考虑其他组的实验结果,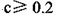 |
C.③组实验中,混合溶液中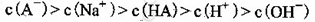 |
D.①组实验中,混合溶液中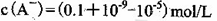 |
D
解析试题分析:A、由①一元酸与一元强碱等体积混合,溶液呈碱性,说明该酸为弱酸,所以HA的电离方程式正确;B、不考虑其他组的实验结果,与氢氧化钠等体积混合溶液呈中性时,说明若酸为强酸则c=0.2,若酸为 弱酸则酸过量,c>0.2,所以c≥0.2,正确;C、③组中,溶液呈酸性,所得溶液为NaA和HA的混合液,酸的电离大于酸根离子的水解程度,所以离子浓度的大小关系是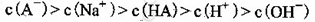 ,正确;D、根据物料守恒和质子守恒得c(A-)=(0.05+10-9-10-5)mol/L,错误,答案选D。
,正确;D、根据物料守恒和质子守恒得c(A-)=(0.05+10-9-10-5)mol/L,错误,答案选D。
考点:考查混合溶液中离子浓度的比较,守恒规律的应用,电解质强弱的判断

 名校课堂系列答案
名校课堂系列答案50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)=4.0mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1 |
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2mol/L |
| B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)=1×10-7mol/L |
| D.V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |
已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17。若向5mL含有KCl和KI各为0.01mol/L的混合溶液中加入8mL 0.01mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是
| A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
难溶化合物的溶解能力可以用溶度积Ksp来表示,当溶液中相应离子浓度的乘积大于该值时,会形成沉淀。已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17。若在常温下,向5 mL含有KCl和KI各为0.01 mol/L的溶液中加入8 mL 0.01 mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是( )
| A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
常温下,向l00mL 0.01 mol?L-1盐酸中逐滴加入0.02 mol?L-1 MOH溶液,如下图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是( )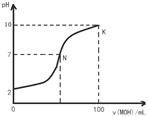
| A.MOH是弱碱 |
| B.N点c(Cl-) = c(M+) |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.K点对应的溶液c(MOH)+c(OH-)-c(H+) = 0.005 mol?L-1 |
下列实验步骤与实验事实的相应结论解释正确的是
| 选项 | 实验步骤与实验事实 | 结论解释 |
| A | Mg(OH)2、Al(OH)3混合物中加入NaOH溶液,Al(OH)3溶解而Mg(OH)2没有溶解 | Mg(OH)2Ksp比Al(OH)3的小 |
| B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的小 |
| C | 在溶有NH3的BaCl2溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
| D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |