题目内容
难溶化合物的溶解能力可以用溶度积Ksp来表示,当溶液中相应离子浓度的乘积大于该值时,会形成沉淀。已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17。若在常温下,向5 mL含有KCl和KI各为0.01 mol/L的溶液中加入8 mL 0.01 mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是( )
| A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
A
解析试题分析:根据AgCl、AgI的Ksp说明KI先与AgNO3溶液完全反应生成AgI沉淀,然后是部分KCl与AgNO3溶液反应生成AgCl沉淀,此时溶液中所含溶质的离子浓度大小为c(K+)>c(NO3- )>c(Cl-)(过量)>c(Ag+)>c(I-),A项正确。
考点:溶度积(Ksp)判断物质的溶解度、离子浓度的大小比较。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混台后所得溶液
的pH如下表: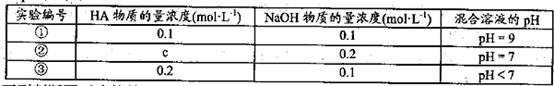
下列判断不正确的是
A.HA的电离方程式为: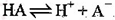 |
B.不考虑其他组的实验结果,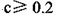 |
C.③组实验中,混合溶液中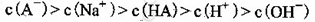 |
D.①组实验中,混合溶液中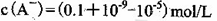 |
25℃时,下列各溶液(均为0.1 mol·L-1)中,离子(或分子)的物质的量浓度关系正确的是
| A.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.碳酸钠溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol·L-1 |
| C.醋酸钠溶液中:c(OH-)>c(H+)+c(CH3COOH) |
| D.碳酸氢钠溶液中:c(Na+)-c(OH-)=c(HCO3-)+c(CO32-)-c(H+) |
下列说法正确的是
| A.两种难溶物中溶解度小的物质其KSP不一定小 |
| B.同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C.因为Ksp(BaSO4)= 1.08×l0-l0,Ksp(BaCO3)=8.1×10-9,所以BaSO4沉淀不可能转化为BaCO3沉淀 |
| D.相同温度下,将足量AgCl固体分别加入同体积的①0.1mo1·L-l盐酸、②0.1mo1·L-1氯化镁溶液、③0.1mo1·L-l l硝酸银溶液中,c(Ag+):③>②>① |
将一定量下列溶液混合后加热蒸干并灼烧,所得固体不可能为纯净物的是 ( )
| A.FeCl3与FeCl2 | B.KHCO3与KOH | C.NH4Cl与NaCl | D.AlCl3与Al2(SO4)3 |
某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。据图判断错误的是
| A.a的数值一定大于9 |
| B.I为氢氧化钠溶液稀释时溶液的pH变化曲线 |
| C.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V( NaOH)<V(氨水) |
| D.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大 |
常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是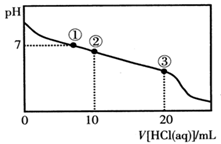
| A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH) |
常温下,0.1mol/L的氨水pH=11,下列叙述错误的是
| A.向该溶液中加水稀释:c(OH—)/c(NH3·H2O )增大 |
| B.0.lmol/L氨水与0.lmol/LH2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(H+)=2c(SO42—)+c(OH—) |
| C.0.1mol/L氨水与0.05mol/LHCl溶液等体积混合后所得溶液中:c(NH4+)+n(NH3)+n(NH3·H2O)=2n(Cl—) |
| D.浓度均为0.1mol/L氨水和NH4Cl溶液等体积混合后,若溶液呈碱性,则 |