题目内容
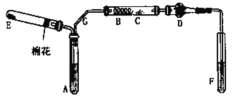
【题目】科学家采用碳基电极材料设计了一种制取氯气的新工艺方案,装置如图所示:下列说法错误的是( )

A.反应过程中需要不断补充Fe2+
B.阳极反应式是2HCl- 2e- =Cl2+2H+
C.电路中转移1 mol电子,消耗标况下氧气5.6 L
D.电解总反应可看作是4HCl(g)+O2(g)=2Cl2(g) + 2H2O(g)
【答案】A
【解析】
HCl在阳极失电子,发生氧化反应,生成Cl2和H+,Fe3+在阴极得电子,还原成Fe2+,Fe2+、H+、O2反应生成Fe3+和H2O,Fe2+、Fe3+在阴极循环。
A.由分析可知,Fe2+在阴极循环,无需补充,A错误;
B.HCl在阳极失电子得到Cl2和H+,电极反应式为:2HCl- 2e- =Cl2+2H+,B正确;
C.根据电子得失守恒有:O2~4e-,电路中转移1 mol电子,消耗0.25mol氧气,标况下体积为5.6 L,C正确;
D.由图可知,反应物为HCl(g)和O2(g),生成物为H2O(g)和Cl2(g),故电解总反应可看作是4HCl(g)+O2(g)=2Cl2(g)+ 2H2O(g),D正确。
答案选A。

【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 118 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。
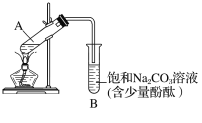
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄
B.下层液体红色变浅或变为无色
C.有气体产生
D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:

①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
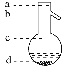
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外,还需要的玻璃仪器有__________、________、________、________,收集乙酸的适宜温度是_______________________________________。
【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为_____。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3并推断Na2CO3的水解程度______NaHCO3 (填”大于”或”小于”)。丙同学认为甲、乙的判断都不充分。
丙认为: (1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则____(填”甲”或”乙”)判断正确。试剂X是____。
A.Ba(OH)2溶液 B.BaCl2溶液 C.AlCl3溶液 D.澄清石灰水
(2)查阅资料发现NaHCO3的分解温度为150℃,丙断言____(填”甲”或”乙”)的判断是错误的,理由是___________。