题目内容
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 118 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。
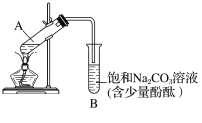
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄
B.下层液体红色变浅或变为无色
C.有气体产生
D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:
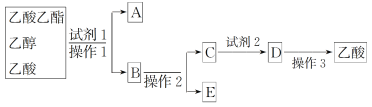
①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外,还需要的玻璃仪器有__________、________、________、________,收集乙酸的适宜温度是_______________________________________。
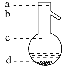
【答案】ABCD 饱和碳酸钠溶液 分液 分液漏斗 稀硫酸 蒸馏 b 酒精灯 冷凝管 牛角管 锥形瓶 略高于 118 ℃
【解析】
乙醇、乙酸的沸点较低,易挥发;根据乙酸的酸性和乙酸乙酯难溶于饱和碳酸钠分析;
(1)饱和碳酸钠溶液上方收集到较多液体包括乙酸乙酯、乙酸、乙醇。乙酸乙酯有果香味,不溶解且密度比水小,乙酸和能碳酸钠反应放出CO2气体,乙醇可以和饱和碳酸钠溶液互溶,取下小试管B,充分振荡,静置。可以产生的现象为:有果香味;上层液体变薄;下层液体红色变浅或变为无色;同时有气体产生。所以A B C D均符合题意;答案:A B C D。
(2)①制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,所以试剂1最好选用饱和碳酸钠溶液,因此,本题正确答案是:饱和碳酸钠溶液;
②乙酸乙酯不溶于碳酸钠溶液,所以混合液会分层,可以通过分液操作分离出乙酸乙酯,使用到的主要仪器为分液漏斗,因此答案是:分液;分液漏斗;
③根据流程可以知道,加硫酸能将乙酸钠转化为乙酸,且硫酸难挥发,不影响下步的蒸馏,因此正确答案是:稀硫酸;
④通过操作1得到乙酸乙酯、碳酸钠、乙酸钠、乙醇的混合液,B为乙酸、乙醇、碳酸钠的混合液,通过蒸馏得到乙醇E,然后加入稀硫酸,再蒸馏得到乙酸,因此,本题正确答案是:蒸馏;
⑤蒸馏的原理:通过控制沸点的不同来实现物质的分离,所以温度计水银球要靠近蒸馏烧瓶支管口,在蒸馏实验中除蒸馏烧瓶、温度计、冷凝管外,还需要的玻璃仪器有酒精灯、牛角管、锥形瓶;乙酸的沸点为118℃,所以收集乙酸的适宜温度是略高于118 ℃,因此答案是:b;酒精灯;冷凝管;牛角管;锥形瓶;略高于118 ℃。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案