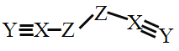题目内容
【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-水解程度增大,故碱性增强,该反应的离子方程式为_____。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3并推断Na2CO3的水解程度______NaHCO3 (填”大于”或”小于”)。丙同学认为甲、乙的判断都不充分。
丙认为: (1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则____(填”甲”或”乙”)判断正确。试剂X是____。
A.Ba(OH)2溶液 B.BaCl2溶液 C.AlCl3溶液 D.澄清石灰水
(2)查阅资料发现NaHCO3的分解温度为150℃,丙断言____(填”甲”或”乙”)的判断是错误的,理由是___________。
【答案】![]()
![]()
![]() 大于 乙 B 乙 常压下加热NaHCO3的水溶液,溶液的温度达不到150 ℃
大于 乙 B 乙 常压下加热NaHCO3的水溶液,溶液的温度达不到150 ℃
【解析】
甲、乙两同学对碳酸氢钠溶液受热后碱性增强的原因进行了猜测,其中甲认为温度升高,促进碳酸氢钠水解,导致溶液碱性增强,而乙认为碳酸氢钠受热发生分解产生了碳酸钠,而由于碳酸钠的水解程度大于碳酸氢钠的水解程度,使溶液碱性增强。若要证明甲、乙的结论,则证明CO32-是否存在即可。若CO32-存在则说明乙对,若CO32-不存在,则说明甲对。以此解题。
甲:碳酸氢钠是强碱弱酸酸式盐,能水解导致溶液呈碱性,其发生水解的方程式为HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
乙:碳酸钠是强碱弱酸盐能水解,其水解的方程式分两步,分别为:CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-。由于碳酸是二元弱酸,第一步电离程度远远大于第二步电离,所以碳酸根离子的第一步水解程度远远大于第二步水解程度,导致碳酸钠的水解程度大于碳酸氢钠的水解程度。
H2CO3+OH-。由于碳酸是二元弱酸,第一步电离程度远远大于第二步电离,所以碳酸根离子的第一步水解程度远远大于第二步水解程度,导致碳酸钠的水解程度大于碳酸氢钠的水解程度。
丙:若要证明甲、乙的结论,则证明CO32-是否存在即可。若CO32-存在则说明乙对,若CO32-不存在,则说明甲对。
(1)碳酸氢钠和氯化钡不反应,但碳酸钠和氯化钡能反应生成白色沉淀碳酸钡 Na2CO3+BaCl2=BaCO3↓+2NaCl。因此向碳酸钠或碳酸氢钠溶液中加入BaCl2溶液,就可鉴别是否存在CO32-。氢氧化钡或氢氧化钙与碳酸钠或碳酸氢钠溶液都生成白色沉淀,无法证明CO32-是否存在。AlCl3溶液与碳酸钠溶液或碳酸氢钠溶液均会发生双水解反应产生白色沉淀和气体,因此也无法证明CO32-是否存在。故答案为:乙、B;
(2)碳酸氢钠的分解温度是150℃,常压下加热NaHCO3的水溶液,溶液的温度达不到150℃,所以碳酸氢钠不分解,溶液仍然是碳酸氢钠溶液,由此判断乙是错误的,故答案为:乙、常压下加热NaHCO3的水溶液,溶液的温度达不到150 ℃。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案