题目内容
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
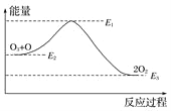
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
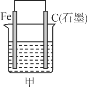
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
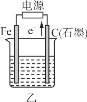
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知相关的化学键键能数据如下:
化学键 | H-H | C-O | | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=______kJ·mol-1(用数值表示),则△H3=______kJ·mol-1(用△H1和△H2表示)。
(2)向恒温、恒容密闭容器中充入一定量的CO(g)和H2(g)进行①反应,下列能说明反应达到平衡状态的是_____(填编号,下同)。
a.体系压强保持不变
b.v正(CO) = v逆(H2)
c.CO与CH3OH的物质的量之比保持不变
d.每消耗1molCO的同时生成1molCH3OH
e.混合气体的密度保持不变
(3)向同温、同体积的甲、乙、丙三个密闭容器中分别充入气体进行①反应。甲容器:2mol H2和1molCO;乙容器:1mol H2和0.5mol CO;丙容器:1mol CH3OH。恒温、恒容下反应达平衡时,下列关系正确的是________。
a.转化率:甲>乙 b.反应放出的热量数值Q:Q甲 = 2Q乙
c.CO的质量m:m甲= m丙> 2m乙 d.容器内压强P:P甲=P丙<2P乙
【答案】-99 △H2-△H1 ac ad
【解析】
(1)利用键能计算,△H1=反应物的总键能-生成物的总键能,反应②-反应①即得△H3。
(2)a.反应前后气体分子数不等,体系压强保持不变,则达平衡状态;
b.CO与H2的化学计量数不等,则v正(CO) = v逆(H2)不是平衡状态;
c.只要平衡移动,CO与CH3OH的物质的量之比发生改变,现比值保持不变,则达平衡状态;
d.不管反应是否达到平衡,每消耗1molCO的同时生成1molCH3OH,C不一定达平衡状态;
e.气体的质量不变、容器的体积不变,混合气体的密度始终不变,e不一定达平衡状态。
(3)a.甲的浓度为乙的二倍,则甲相当于乙加压,平衡正向移动,则转化率甲>乙,a正确;
b.甲中气体的物质的量是乙的二倍,且平衡正向移动,所以反应放出的热量数值Q甲 > 2Q乙 ,b错误;
c.甲与丙是等效平衡,CO的质量m甲= m丙;甲中气体的物质的量是乙的二倍,且平衡正向移动,则m甲<2m乙,c错误;
d.甲与丙是等效平衡,容器内压强P甲=P丙;乙相当于甲的体积减为原来的一半,则平衡正向移动,P甲<2P乙,d正确。
(1)利用键能进行计算,△H1=(1076+2×436-3×413-343-465)kJ/mol=-99kJ/mol;
反应②-反应①即得△H3=(△H2-△H1)kJ/mol。答案为:-99;△H2-△H1;
(2)a.反应前后气体分子数不等,体系压强保持不变,则达平衡状态;
b.CO与H2的化学计量数不等,则v正(CO) = v逆(H2)不是平衡状态;
c.只要平衡移动,CO与CH3OH的物质的量之比发生改变,现比值保持不变,则达平衡状态;
d.不管反应是否达到平衡,每消耗1molCO的同时生成1molCH3OH,C不一定达平衡状态;
e.气体的质量不变、容器的体积不变,混合气体的密度始终不变,e不一定达平衡状态。
故ac能说明反应达平衡状态。答案为:ac;
(3)a.甲的浓度为乙的二倍,甲相当于乙加压,平衡正向移动,则转化率甲>乙,a正确;
b.甲中气体的物质的量是乙的二倍,且平衡正向移动,所以反应放出的热量数值Q甲 > 2Q乙 ,b错误;
c.甲与丙是等效平衡,CO的质量m甲= m丙;甲中气体的物质的量是乙的二倍,且平衡正向移动,则m甲<2m乙,c错误;
d.甲与丙是等效平衡,容器内压强P:P甲=P丙;乙相当于甲的体积减为原来的一半,则平衡正向移动,P甲<2P乙,d正确。
故ad正确。答案为:ad。