题目内容
某化学研究性学习小组对电解质溶液作如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中各离子的浓度一定降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42—)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液pH是乙溶液pH的两倍,则甲乙两溶液等体积混合,混合液pH可能等于7
其归纳正确的是( )
A.全部 B.③⑤⑥ C.④⑤⑥ D.①②④
B
【解析】 ①中c(OH-)增大;②中之比为1∶10;③因为CaCl2溶液中的c(Cl-)大于NaCl溶液中的,依据AgCl(s) Ag+(aq)+Cl-(aq),可知AgCl在NaCl溶液中的溶解程度大,正确;④溶液呈中性时,一定含有NH4+,依据电荷守恒c(Na+)+c(NH4+)+c(H+)=2c(SO42—)+c(OH-)可知c(Na+)+c(NH4+)=2c(SO42—),错误;⑤依据CH3COOH??CH3COO-+H+、Ka=
Ag+(aq)+Cl-(aq),可知AgCl在NaCl溶液中的溶解程度大,正确;④溶液呈中性时,一定含有NH4+,依据电荷守恒c(Na+)+c(NH4+)+c(H+)=2c(SO42—)+c(OH-)可知c(Na+)+c(NH4+)=2c(SO42—),错误;⑤依据CH3COOH??CH3COO-+H+、Ka=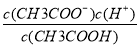 ;CH3COO-+H2O??CH3COOH+OH-、Kh=
;CH3COO-+H2O??CH3COOH+OH-、Kh= ,可知Ka·Kh=c(H+)·c(OH-),正确;⑥设乙溶液pH=a,甲溶液pH=2a,混合后溶液呈中性即10-a·V(酸)=102a-14·V(碱),所以-a=2a-14,此时a=14/3,正确。
,可知Ka·Kh=c(H+)·c(OH-),正确;⑥设乙溶液pH=a,甲溶液pH=2a,混合后溶液呈中性即10-a·V(酸)=102a-14·V(碱),所以-a=2a-14,此时a=14/3,正确。

孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。
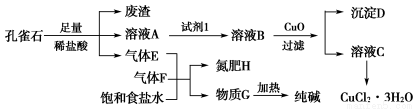
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
金属离子 | Fe3+ | Fe2+ | Cu2+ | |
pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(1)图中“试剂1”为________。
(2)加入CuO的作用是调节溶液pH,则pH的范围为________。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中。其中,应先通入的气体是________(填代号及对应物质的化学式)。
(4)由溶液C获得CuCl2·3H2O,需要经过__________、________、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
物质 | 甲 | 乙 | CO | H2 |
燃烧热/(kJ·mol-1) | 1 366 | 5 518 | 283 | 286 |
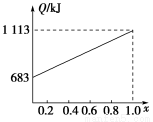
取甲、乙按不同比例混合的燃油23 g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
(1)乙的相对分子质量Mr(乙)=________。
(2)160 g由甲、乙以等物质的量混合而成的燃油在347.2 L O2中恰好完全燃烧,得492.8 L气体,冷却到室温时,还剩余224 L(气体体积均在标准状况下测定)。由此可求得混合物中,C、H、O的原子个数比为________。甲、乙的分子式为:甲________;乙________。
(3)1 mol由甲、乙以等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2 876 kJ,则反应中生成CO________mol。