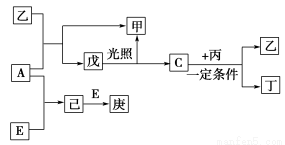
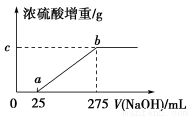
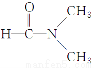
题目内容
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
物质 | 甲 | 乙 | CO | H2 |
燃烧热/(kJ·mol-1) | 1 366 | 5 518 | 283 | 286 |
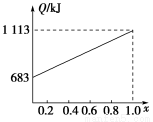
取甲、乙按不同比例混合的燃油23 g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求:
(1)乙的相对分子质量Mr(乙)=________。
(2)160 g由甲、乙以等物质的量混合而成的燃油在347.2 L O2中恰好完全燃烧,得492.8 L气体,冷却到室温时,还剩余224 L(气体体积均在标准状况下测定)。由此可求得混合物中,C、H、O的原子个数比为________。甲、乙的分子式为:甲________;乙________。
(3)1 mol由甲、乙以等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2 876 kJ,则反应中生成CO________mol。
(1)114 (2)10∶24∶1 C2H6O C8H18 (3)2
【解析】 (1)当x=1.0时,燃油全部是乙,n(乙)=1113/5518=0.201 7 mol,则Mr(乙)=23/0.2017=114。当x=0时,同理可得Mr(甲)=46。
(2)160 g混合物燃烧生成n(CO2)=224/22.4=10 mol,n(H2O)=(492.8—224)/22.4=12 mol,根据CO2和H2O中的氧元素之和与消耗氧气的差值求得原混合物中含n(O)=1 mol,所以C、H、O的原子个数比为10∶24∶1。
设160 g混合物的物质的量为n mol,则
114n+46n=160,解得n=1。
所以甲的分子式为C2H6O,乙的分子式为C8H18。
(3)1 mol混合物完全燃烧应放出热量(1366+5518)/2kJ=3 442 kJ,实际放出热量2 876 kJ,所以生成CO的物质的量为(3442—2876)/283=2 mol。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案