题目内容
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。
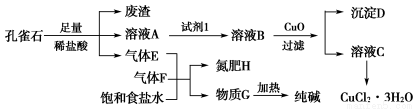
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题:
金属离子 | Fe3+ | Fe2+ | Cu2+ | |
pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(1)图中“试剂1”为________。
(2)加入CuO的作用是调节溶液pH,则pH的范围为________。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中。其中,应先通入的气体是________(填代号及对应物质的化学式)。
(4)由溶液C获得CuCl2·3H2O,需要经过__________、________、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O Cu(OH)2+2H+的平衡常数为________。
Cu(OH)2+2H+的平衡常数为________。
(1)Cl2或H2O2
(2)3.2≤pH<4.7
(3)F——NH3
(4)蒸发浓缩 冷却结晶
(5)5×10-9
【解析】 (1)Fe2+开始沉淀时的pH为7.0,此时Cu2+已完全沉淀。所以欲除去Cu2+中混有的Fe2+时,必须先将其氧化为Fe3+。为避免引入新杂质,试剂1可以是氯气或H2O2。
(2)调节pH的原则是使Fe3+完全沉淀而Cu2+不沉淀。
(3)CO2在饱和食盐水中的溶解度小,因此必须先通入NH3。
(5)Cu2++2H2O Cu(OH)2+2H+的平衡常数K=
Cu(OH)2+2H+的平衡常数K= 。根据Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)及常温下Kw=c(H+)·c(OH-)得:K=
。根据Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)及常温下Kw=c(H+)·c(OH-)得:K= =
=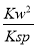 =
=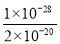 =5×10-9。
=5×10-9。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
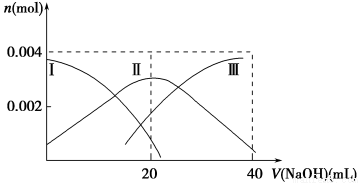
小学教材完全解读系列答案T ℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得H2和CH3OH(g)的浓度随时间变化如下表所示。下列说法不正确的是( )
时间/min | c(H2)/mol·L-1 | c(CH3OH)/mol·L-1 | v(正)和v(逆)比较 |
t0 | 6 | 0 | ? |
t1 | 3 | 1 | v(正)=v(逆) |
A.t0~t1时间内v(H2)=3/(t1-t0) mol·L-1·min-1
B.t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率
C.t0时,v(正)>v(逆)
D.T ℃时,平衡常数K=1/27,CO2与H2的转化率相等