题目内容
5.下列表示对应化学反应或过程的离子方程式正确的是( )| A. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 用石墨作电极电解AlCl3溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| D. | FeCl3溶液用于蚀刻印刷电路:Cu+2Fe3+═Cu2++2Fe2+ |
分析 A.电荷不守恒;
B.碳酸氢钙与过量的NaOH溶液反应生成碳酸钙、碳酸钠和水;
C.应生成氢氧化铝沉淀;
D.氯化铁与铜反应生成氯化亚铁和氯化铜.
解答 解:A.电荷不守恒,应为Cu+2Ag+═Cu2++2Ag,故A错误;
B.碳酸氢钙与过量的NaOH溶液反应生成碳酸钙、碳酸钠和水,反应的离子方程式为Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32-,故B正确;
C.应生成氢氧化铝沉淀,离子方程式为2Al3++6Cl-+6H2O$\frac{\underline{\;电解\;}}{\;}$ 3Cl2↑+3H2↑+2Al(OH)3↓,故C错误;
D.氯化铁与铜反应生成氯化亚铁和氯化铜,反应的离子方程式为Cu+2Fe3+═Cu2++2Fe2+,故D正确.
故选BD.
点评 本题考查离子反应方程式的书写,明确发生的化学反应及离子反应方程式的书写方法即可解答,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
15.下列实验方案合理的是( )
| A. | 用溴水或酸性KMnO4溶液鉴别甲烷和乙烯 | |
| B. | 向酒精中加入足量生石灰检验酒精中是否含有少量水 | |
| C. | 在盛有2mL无水乙醇的试管中放入绕成螺旋状的光洁铜丝,加热可制得乙醛 | |
| D. | 将裂解气通入到酸性KMnO4溶液中来证明裂解气中是否有乙烯 |
16.已知某条件下,合成氨反应的数据如下:
N2(g)+3H2(g)?2NH3(g)
起始浓度(mol•L-1):1.0 3.0 0.2
2s末浓度(mol•L-1):0.6 1.8 1.0
4s末浓度(mol•L-1):0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的化学反应速率时,下列说法错误的是( )
N2(g)+3H2(g)?2NH3(g)
起始浓度(mol•L-1):1.0 3.0 0.2
2s末浓度(mol•L-1):0.6 1.8 1.0
4s末浓度(mol•L-1):0.4 1.2 1.4
当用氨气浓度的增加来表示该反应的化学反应速率时,下列说法错误的是( )
| A. | 2~4 s内的平均反应速率为0.2 mol•L-1•s-1 | |
| B. | 前4 s内的平均反应速率为0.3 mol•L-1•s-1 | |
| C. | 前2 s内的平均反应速率为0.4 mol•L-1•s-1 | |
| D. | 2 s末的反应速率为0.4 mol•L-1•s-1 |
13.下列说法一定正确的是( )
| A. | 其他条件不变时,增大反应的物质的量,反应速率增大,化学平衡发生移动 | |
| B. | 其他条件不变时,升高温度,化学平衡向放热反应的方向移动 | |
| C. | 其他条件不变时,增大压强,化学反应速率增大,化学平衡发生移动 | |
| D. | 其他条件不变时,使用催化剂,化学反应速率改变,化学平衡不移动 |
17.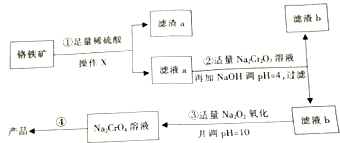 以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
已知:①酸性溶液中Cr的+6价易被还原为+3价;当pH>9时Cr以CrO2-形式存在且易被氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)滤渣a的主要成分的化学式是SiO2;操作X用到的玻璃仪器有烧杯、玻璃棒、和漏斗.
(2)第④步得到产品涉及到的操作有蒸发浓缩、降温结晶、过滤、洗涤等.
(3)第①步反应的离子方程式是FeO+2H+=Fe2++H2O、Cr2O3+6H+=2Cr3++3H2O,第②步产生滤渣b的原因是Fe3+水解生成氢氧化铁沉淀.
(4)已知:1molAl完全燃烧放热a KJ,1mol Fe完全燃烧生成Fe3O4放热b KJ,写出Al与Fe3O4发生铝热反应的热化学方程式8Al(s)+3Fe3O4 (s)=9Fe(s)+4Al2O3 (s),△H=(8a-9b)kJ/mol.
(5)若现有224kg铬铁矿(其中含FeO•Cr2O3 50%),按上述流程最多可以得到Na2CrO4产品的质量是189kg(假设每步均恰好完全转化).
 以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.已知:①酸性溶液中Cr的+6价易被还原为+3价;当pH>9时Cr以CrO2-形式存在且易被氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Fe2+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | |
| 沉淀完全的pH | 3.7 | 9.6 | 9(>9)溶解 |
(2)第④步得到产品涉及到的操作有蒸发浓缩、降温结晶、过滤、洗涤等.
(3)第①步反应的离子方程式是FeO+2H+=Fe2++H2O、Cr2O3+6H+=2Cr3++3H2O,第②步产生滤渣b的原因是Fe3+水解生成氢氧化铁沉淀.
(4)已知:1molAl完全燃烧放热a KJ,1mol Fe完全燃烧生成Fe3O4放热b KJ,写出Al与Fe3O4发生铝热反应的热化学方程式8Al(s)+3Fe3O4 (s)=9Fe(s)+4Al2O3 (s),△H=(8a-9b)kJ/mol.
(5)若现有224kg铬铁矿(其中含FeO•Cr2O3 50%),按上述流程最多可以得到Na2CrO4产品的质量是189kg(假设每步均恰好完全转化).
14.图为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
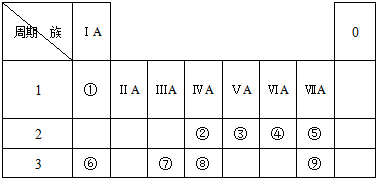
(1)②是C.
(2)9种元素中非金属性最强的是F.
(3)④⑥⑦的原子半径由小到大的顺序为O<Al<Na.
(4)②③⑧的最高价含氧酸的酸性由弱到强的顺序是H2SiO3<H2CO3<HNO3.
(5)由以上某些元素组成的有机化合物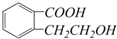 ,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.
,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.
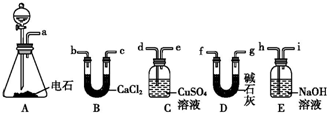
(6)某化学兴趣小组为探究⑨单质、Br2、Fe3+的氧化性强弱,设计了如下实验: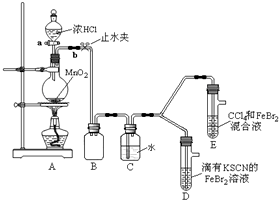
①整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
②用改正后的装置进行实验,实验过程如下:

(1)②是C.
(2)9种元素中非金属性最强的是F.
(3)④⑥⑦的原子半径由小到大的顺序为O<Al<Na.
(4)②③⑧的最高价含氧酸的酸性由弱到强的顺序是H2SiO3<H2CO3<HNO3.
(5)由以上某些元素组成的有机化合物
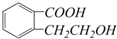 ,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.
,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.(6)某化学兴趣小组为探究⑨单质、Br2、Fe3+的氧化性强弱,设计了如下实验:

①整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
②用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化,持续通入一段时间后,CCl4层变为棕色 | ⑨单质、Br2、Fe3+的氧化性由强到弱的顺序是: ⑨单质(或Cl2)>Br2>Fe3+ |
 营养平衡、科学使用食品添加剂有助于健康和提高免疫力.
营养平衡、科学使用食品添加剂有助于健康和提高免疫力.