题目内容
W、X、Y、Z为四种短周期主族元素,其位置关系如图。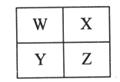
(1)若X原子的最外层电子数是次外层的3倍。
①元素X在周期表中的位置___________________________________。
②工业上由W的单质制备W的气态氢化物的化学方程式是
_______________________________________________________________________。
(2)若四种元素中只有一种金属元素。
①冶炼Y的化学方程式是__________________________________________。
②工业上,将X的单质与Z的最高价氧化物加热到1900℃以上可制得一种新型陶瓷(ZX),同时得到一种可燃性气体,该反应的化学方程式是
_________________________________
③为比较X、Z最高价氧化物的水化物酸性强弱,某同学设计如下实验。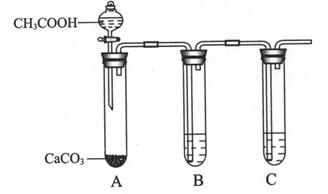
I. B试管中盛放的试剂是______________________。
II. C试管中反应的化学方程式是___________________________________。
(12分,每空2分)(1)① 第2周期VIA族②N2+3H2高温、高压催化剂 2NH3
(2)① ②
②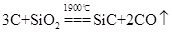
③I. 饱和NaHCO3溶液(答NaHCO3给分) II. 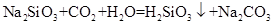
解析试题分析:(1)若X原子的最外层电子数是次外层的3倍,X是第二周期元素,所以X是氧元素,则W是氮元素,Y是P元素,Z是S元素。
①元素X在周期表中的位置第2周期VIA族。
②工业上由W的单质制备W的气态氢化物的化学方程式是N2+3H2高温、高压催化剂 2NH3。
(2)若四种元素中只有一种金属元素,则根据元素在周期表中的相对位置可知,Y应该是金属,且是金属铝,W是B,X是C,Z是Si。
①铝是活泼的金属,通过电解熔融的氧化铝冶炼,反应的化学方程式是2Al2O3(熔融)  4Al+3O2↑。
4Al+3O2↑。
②工业上,将X的单质与Z的最高价氧化物加热到1900℃以上可制得一种新型陶瓷(ZX),同时得到一种可燃性气体,则根据原子守恒可知,该可燃性气体是CO,所以该反应的化学方程式是3C+SiO2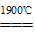 SiC+2CO↑。
SiC+2CO↑。
③I. 由于乙酸是易挥发的,所以生成的CO2中含有乙酸,乙酸能干扰后续的实验,需要除去。除去CO2中的乙酸需要饱和碳酸氢钠溶液,即B试管中盛放的试剂是饱和NaHCO3溶液。
II. 要证明碳酸的酸性强于硅酸的,则C中应该盛放硅酸钠溶液,所以C试管中反应的化学方程式是Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3。
考点:考查元素周期表的结构、物质的合成与制备、金属冶炼以及最高价氧化物水化物酸性强弱比较等
点评:该题是中等难度的试题,试题针对性强,贴近高考,难易适中。有利于培养学生规范的答题能力和实验设计能力,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等。填写下列空白。
| | | A | |
| B | C | | D |
(1)写出C的氧化物的一种用途:
(2)B单质与Fe2O3反应时,每消耗13.5g B时放热213kJ,该反应的热化学方程式是
(3)为防止A元素的氧化物AO2污染空气,科学家寻求合适的化合物G和催化剂,以实现反应:
AO2+X催化剂A2 +H2O+n Z(未配平,n可以为0)。上述反应式中的X不可能是 (填标号)。
a.NH3 b.CO c.CH3CH2OH d.H2O2
(4)A元素的最简单氢化物甲、D元素的最高价氧化物对应的水化物乙都是很重要的基础化工原料。
①一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是 (选填序号)。
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
②25℃时,往a mol·L-1的甲的水溶液中滴加0.01 mol·L-1乙溶液,当两种溶液等体积混合时,溶液呈中性(设温度不变)。滴加过程中溶液的导电能力 (填“增强”、“减弱”或“不变”);
所得混合溶液中A、D两种元素的物质的量的关系为:A 2D(填“大于”、“等于”或“小于”);甲中溶质的电离平衡常数Kb= (用含a的代数式表示)。
下表为元素周期表的一部分。请回答下列问题:
根据元素在周期表中的相对位置可知①~⑩分别是H、C、N、O、Mg、Al、Cl、Ca、Mn、Fe。
(1)上述元素中,属于s区的是____________(填元素符号)。
(2)写出元素④的基态原子的价电子排布图____________________。
(3)元素第一电离能为⑨________⑩ (填“大于”或“小于”)。
(4)元素③气态氢化物的VSEPR模型为________;该分子为________分子(填“极性”或“非极性”)。向硫酸铜溶液中逐滴加入其水溶液,可观察到的现象为_____________________________。
(5)⑥单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
若已知⑥的原子半径为dcm,NA代表阿伏加德罗常数,元素⑥的相对原子质量为M,请回答:晶胞中⑥原子的配位数为 ,该晶体的密度为 (用字母表示)
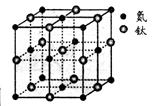
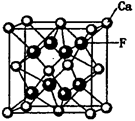
(6)实验证明:⑤和⑧的氧化物、KCl、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: (用化学式填写)。
其中⑧的氧化物晶体中一个阳离子周围和它最邻近且等距离的阳离子有 个。
 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C
存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C 互为等电子体,O
互为等电子体,O