题目内容
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等。填写下列空白。
| | | A | |
| B | C | | D |
(1)写出C的氧化物的一种用途:
(2)B单质与Fe2O3反应时,每消耗13.5g B时放热213kJ,该反应的热化学方程式是
(3)为防止A元素的氧化物AO2污染空气,科学家寻求合适的化合物G和催化剂,以实现反应:
AO2+X催化剂A2 +H2O+n Z(未配平,n可以为0)。上述反应式中的X不可能是 (填标号)。
a.NH3 b.CO c.CH3CH2OH d.H2O2
(4)A元素的最简单氢化物甲、D元素的最高价氧化物对应的水化物乙都是很重要的基础化工原料。
①一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是 (选填序号)。
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
②25℃时,往a mol·L-1的甲的水溶液中滴加0.01 mol·L-1乙溶液,当两种溶液等体积混合时,溶液呈中性(设温度不变)。滴加过程中溶液的导电能力 (填“增强”、“减弱”或“不变”);
所得混合溶液中A、D两种元素的物质的量的关系为:A 2D(填“大于”、“等于”或“小于”);甲中溶质的电离平衡常数Kb= (用含a的代数式表示)。
(14分,7空,每空2分)(1)制备单晶硅、玻璃、光导纤维、建筑材料等(合理答案即可给分)
(2)2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s) △H=-852kJ·mol-1
(3)b (4) ①a、c ; ②增强 ; 大于; 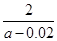 ×10-9
×10-9
解析试题分析:根据元素在周期表中的相对位置可知,B是第三周期元素。又因为B所处的周期序数与族序数相等,所以B是铝元素,则A是N,C是Si,D是S。
(1)硅的氧化物二氧化硅的主要用途是制备单晶硅、玻璃、光导纤维、建筑材料等。
(2)B单质与Fe2O3反应的化学方程式是2Al+Fe2O3 2Fe+Al2O3,由于每消耗13.5g B时放热213kJ,则消耗2mol铝放出的热量是
2Fe+Al2O3,由于每消耗13.5g B时放热213kJ,则消耗2mol铝放出的热量是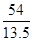 ×213kJ=852kJ,因此该反应的热化学方程式是2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s) △H=-852kJ/mol。
×213kJ=852kJ,因此该反应的热化学方程式是2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s) △H=-852kJ/mol。
(3)根据方程式可知,NO2中氮元素的化合价从+4价降低到0价,得到电子,发生还原反应。则X一定失去电子,做还原剂。又因为反应中还有水生成,这说明X中一定含有氢元素,所以X不可能是CO,答案选b。
(4)①氨气分解的方程式是2NH3 N2+3H2,该反应是体积增大的吸热的可逆反应。升高温度平衡向正反应方向移动,氨气的物质的量减少,a正确;升高温度平衡向正反应方向移动,平衡常数增大,b不正确;增加氢气的物质的量,平衡向逆反应方向移动,氨气的转化率降低,c正确;增加氨气的物质的量,平衡向正反应方向移动,生成物的物质的量增加,d不正确,答案选ac。
N2+3H2,该反应是体积增大的吸热的可逆反应。升高温度平衡向正反应方向移动,氨气的物质的量减少,a正确;升高温度平衡向正反应方向移动,平衡常数增大,b不正确;增加氢气的物质的量,平衡向逆反应方向移动,氨气的转化率降低,c正确;增加氨气的物质的量,平衡向正反应方向移动,生成物的物质的量增加,d不正确,答案选ac。
②一水合氨是弱电解质,加入硫酸生成强电解质硫酸铵,因此溶液的导电能力增强;如果二者恰好反应生成硫酸铵,则溶液中NH4+水解,溶液显酸性。如果溶液显中性,则说明氨水过量,所以所得混合溶液中A、D两种元素的物质的量的关系为:A大于2D;根据电荷守恒可知c(H+)+c(NH4+)=c(OH-)+2c(SO42-),溶液显中性,则c(H+)=c(OH-),所以c(NH4+)=2c(SO42-)=2×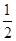 ×0.01mol/L=0.01mol/L。根据氮元素守恒可知,溶液中c(NH3·H2O)=
×0.01mol/L=0.01mol/L。根据氮元素守恒可知,溶液中c(NH3·H2O)=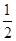 ×amol/L-0.01mol/L,所以根据电离平衡NH3·H2O
×amol/L-0.01mol/L,所以根据电离平衡NH3·H2O NH4++OH-可知,该温度下氨水的电离平衡常数Kb=
NH4++OH-可知,该温度下氨水的电离平衡常数Kb= =
=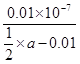 =
=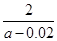 ×10-9。
×10-9。
考点:考查元素周期表的结构、热化学方程式的书写、外界条件对平衡状态的影响、弱电解质的电离以及电离平衡常数的计算等

 阅读快车系列答案
阅读快车系列答案下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
(1)④、⑤、⑥的原子半径由大到小的顺序为________________。(用元素符号表示)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是________。(用化学式表示)
(3)某化合物由①、④、⑧三种元素组成,它有强氧化性,是很好的漂白剂、杀菌剂,请写出它的化学式:____________________。
(4)Ⅰ.下列可作为比较② 和③ 非金属性强弱的依据是 (填序号)。
a.自然界中的含量 b.氢化物的稳定性
c.最高氧化物水化物溶液的酸性 d.单质与酸反应时失去的电子数
Ⅱ.从原子结构的角度解释③ 的非金属性强于② 的原因:电子层数相同,核电荷数③ 大于② ,原子半径③ ②,所以原子核对最外层电子的吸引力③ ②,得电子能力③ 大于② 。
(5)⑥的氧化物与③的最高氧化物水化物溶液反应的离子方程式 。
有关短周期元素A、B、C、D、E、F的信息如下:
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 最外层电子数是次外层电子数的2倍 |
| C | M层上有3个电子 |
| D | 短周期原子半径最大的主族元素 |
| E | 其单质是淡黄色固体 |
| F | 最高正价与最低负价代数和为6 |
请回答下列问题:
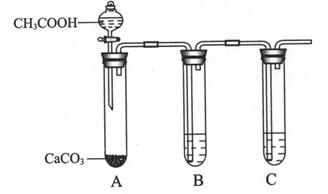
(1)写出实验室制取乙的化学方程式 。
(2)下列说法正确的是 (填序号)。
①实验室可用如图所示装置制取B的最高价氧化物

②用C单质做成的槽车,都可用来运输甲的浓溶液
③ C和铜与稀硫酸组成的原电池,C电极被还原
④ D单质在氧气中燃烧后的产物可用在防毒面具中作供氧剂
⑤鼓励乘坐公交车出行,倡导低碳生活,是控制和治理BO2解决“温室效应”的有效途径之一
 ⑥ DF的电子式为H∶Cl∶
⑥ DF的电子式为H∶Cl∶(3)将E的常见氧化物(该氧化物能使品红溶液褪色)通入由CuSO4和NaCl混合的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀进行元素质量分数分析,可知其中含Cl:35.7%,Cu:64.3%,则该氧化物在上述反应中的作用是 。
A.漂白剂 B.氧化剂 C.还原剂
(4)请用化学方法加以验证(3)中的氧化物,简要写出实验方法、试剂及预期可观察到的现象 。
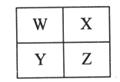
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。
(1)Y在周期表中的位置是 。
(2)用电子式解释X与W能形成化合物X3W的原因 。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是 。
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是 。
(5)已知W的单质与气体B在一定条件下可形成气体A,即: W2 (g)+3B (g)  2A(g) △H =-92.4 kJ?mol―1
2A(g) △H =-92.4 kJ?mol―1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
①W2的平均反应速率v(0min~10min)/ v(10min~20min) = ;
②反应在第10min改变了反应条件,改变的条件可能是 ;
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是 ;
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度