题目内容
15.下列说法正确的是( )①S8分子中 S原子采用的轨道杂化方式sp3
②C2H4分子中只有以s轨道与sp2杂化轨道“头碰头”方式重叠而成的σ键
③SnBr2分子中Sn-Br的键角<120°
④H3O+中H-O-H键角比H2O中H-O-H键角大.
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①③④ |
分析 ①S8是一个环形分子,每个S与两个其它S原子相连,S原子外层6个电子,两对孤对电子,两上σ键,所以S是sp3杂化;
②碳碳双键中一个是σ键,还有一个是π键;
③首先判断价层电子对数目和有无孤电子对,进而判断分子的空间构型;
④先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力.
解答 解:①S8是一个环形分子,每个S与两个其它S原子相连,S原子外层6个电子,两对孤对电子,两上σ键,所以S是sp3杂化,故正确;
②碳碳双键中一个是σ键,还有一个是π键,所以不只是碳氢σ键,故错误;
③SnBr2分子中,Sn原子的价层电子对数目是$\frac{4+2}{2}$=3,配位原子数为2,故Sn含有孤对电子,SnBr2空间构型为V型,键角小于120°,故正确;
④H3O+价层电子对模型为四面体,氧原子采取sp3杂化,H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大,故正确;
故选D.
点评 本题考查了分子或离子中原子轨道杂化类型的判断,根据价层电子对互斥理论来分析解答是关键,注意SnBr2分子中心原子的杂化,题目难度中等.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
5.下列有关化学用语表示正确的是( )
| A. | HClO的电子式: | |
| B. | 中子数为20的氯原子:1720Cl | |
| C. | CCl4的电子式: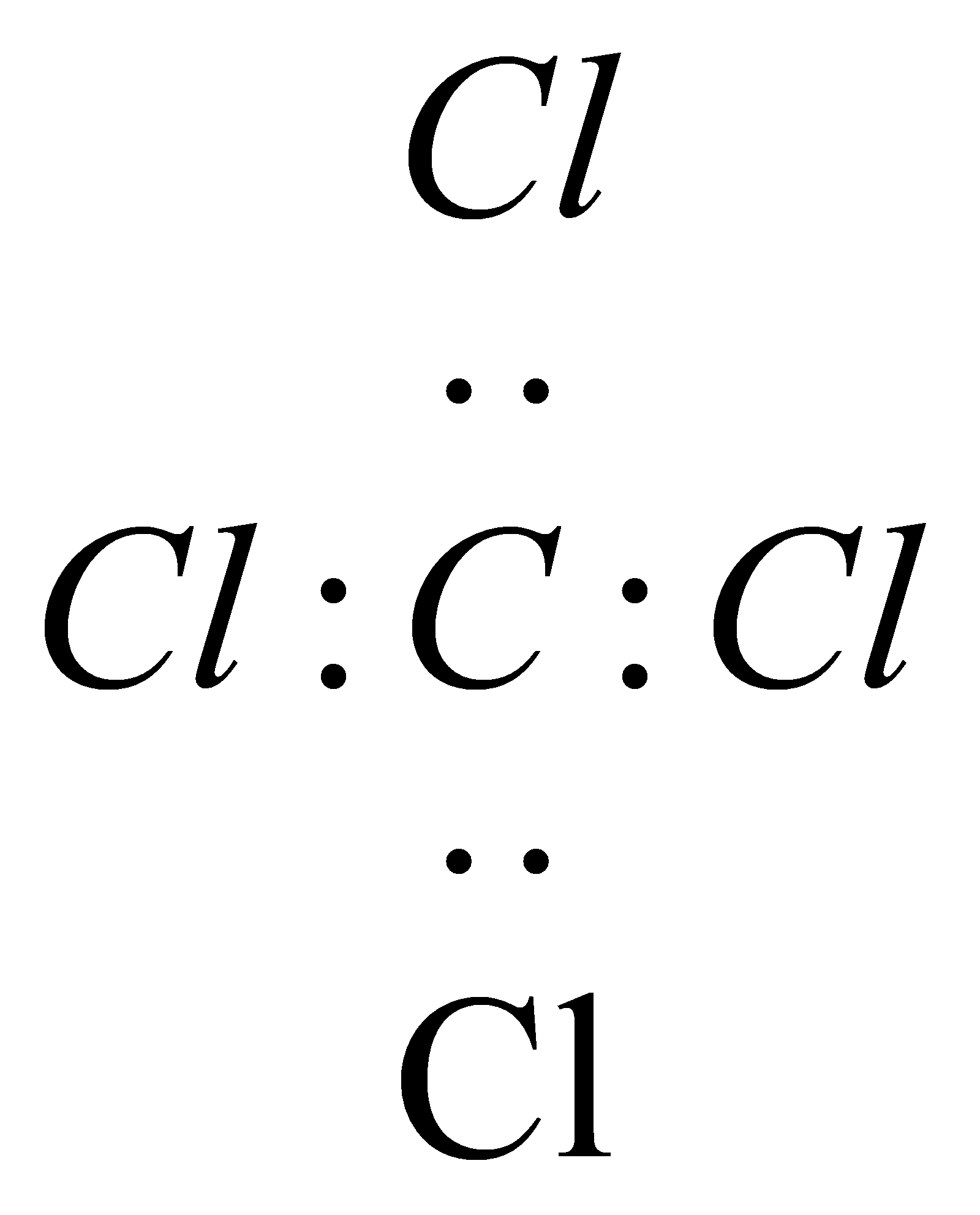 | |
| D. | Cl-的结构示意图: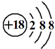 |
6.关于硅及其化合物的叙述中,不正确的是( )
| A. | 硅的单质都可用作半导体材料 | B. | 石英可用来制造光导纤维 | ||
| C. | 碳化硅可用作砂纸、砂轮的磨料 | D. | 水玻璃可作黏合剂及耐火材料 |
10.下列有关叙述正确的是( )
| A. | 只含有离子键的化合物才是离子化合物 | |
| B. | 硫酸铵晶体是含有离子键、极性键和配位键的分子晶体 | |
| C. | 由于I-I键的键能比F-F、Cl-Cl、Br-Br键的键能都小,所以在卤素单质中碘的熔点最低 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
20.V2O5 是一种新型光电材料.某课题组模拟生产V2O5工艺部分流程如下:
Ⅰ.配制偏钒酸钠(NaVO3)溶液
(1)向V2O5 固体中缓慢滴加NaOH溶液,边加热边搅拌至V2O5 固体完全溶解,反应的离子方程式为V2O5+2OH-=2VO3-+H2O.
Ⅱ.沉钒
一定条件下向偏钒酸钠溶液中加入氯化铵溶液,加热、搅拌得到偏钒酸铵沉淀.如图为部分因素对沉钒率的影响.
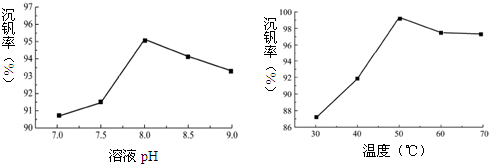
(2)为了提高沉钒率,应调节溶液pH=8.0.已知偏钒酸铵微溶于冷水,可溶于热水,结合图中信息,生成偏钒酸铵沉淀的反应是吸热(填“吸热”或“放热”)反应.
(3)该课题组对影响沉钒率的其他因素(除温度和pH)提出如下假设.
假设一:氯化铵溶液的浓度
假设二:偏钒酸钠溶液浓度
…
(4)结合上述最佳条件设计实验验证假设一,写出实验步骤与结论.
限选试剂:0.5mol/L的偏钒酸钠溶液、1mol/L的氯化铵溶液、蒸馏水,常见实验仪器任选.(提示:沉钒率可用专用仪器测定并计算)
Ⅲ.热分解
(5)偏钒酸铵灼烧产生五氧化二钒,该反应的化学方程式为2NH4VO3$\frac{\underline{\;△\;}}{\;}$2NH3↑+H2O↑+V2O5.
Ⅰ.配制偏钒酸钠(NaVO3)溶液
(1)向V2O5 固体中缓慢滴加NaOH溶液,边加热边搅拌至V2O5 固体完全溶解,反应的离子方程式为V2O5+2OH-=2VO3-+H2O.
Ⅱ.沉钒
一定条件下向偏钒酸钠溶液中加入氯化铵溶液,加热、搅拌得到偏钒酸铵沉淀.如图为部分因素对沉钒率的影响.

(2)为了提高沉钒率,应调节溶液pH=8.0.已知偏钒酸铵微溶于冷水,可溶于热水,结合图中信息,生成偏钒酸铵沉淀的反应是吸热(填“吸热”或“放热”)反应.
(3)该课题组对影响沉钒率的其他因素(除温度和pH)提出如下假设.
假设一:氯化铵溶液的浓度
假设二:偏钒酸钠溶液浓度
…
(4)结合上述最佳条件设计实验验证假设一,写出实验步骤与结论.
限选试剂:0.5mol/L的偏钒酸钠溶液、1mol/L的氯化铵溶液、蒸馏水,常见实验仪器任选.(提示:沉钒率可用专用仪器测定并计算)
| 实验步骤与结论: |
(5)偏钒酸铵灼烧产生五氧化二钒,该反应的化学方程式为2NH4VO3$\frac{\underline{\;△\;}}{\;}$2NH3↑+H2O↑+V2O5.
7.一定条件下,发生可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)下列叙述中,不能做为此可逆反应已经达到化学平衡状态的标志是( )
| A. | NH3的消耗速率等于NO的生成速率 | |
| B. | NH3的消耗速率等于NO的消耗速率 | |
| C. | NH3的浓度和NO的浓度都不发生改变 | |
| D. | 密闭容器内的压强不发生改变 |
4.下列有关物质用途的说法正确的是( )
| A. | 明矾可用作净水剂 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 晶体硅可用于制造光导纤维 | D. | 铝制容器可长期存放酸性食物 |
19.下列说法正确的是( )
| A. | 分子晶体中一定存在分子间作用力 | |
| B. | 分子中含有两个氢原子的酸一定是二元酸 | |
| C. | 含有金属阳离子的晶体一定是离子晶体 | |
| D. | 元素的金属性越强,失去的电子数就越多 |
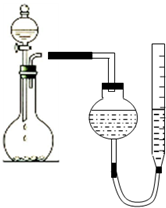 某学生用图所示的装置测定镁的相对原子质量:
某学生用图所示的装置测定镁的相对原子质量: