题目内容
6.下列说法正确的是( )| A. | 除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 | |
| B. | 含有醛基和羰基的有机物都能跟银氨溶液发生银镜反应 | |
| C. | 苯乙烯分子中所有原子可能在一个平面上 | |
| D. | 甲酸分子中有醛基,因此无法区别甲醛溶液和甲酸溶液 |
分析 A.乙烯可被酸性高锰酸钾氧化生成二氧化碳气体;
B.含有羰基的有机物不一定能与银氨溶液发生银镜反应,如丙酮;
C.根据苯、乙烯的平面形结构判断;
D.甲酸含有羧基,具有酸性.
解答 解:A.乙烯可被酸性高锰酸钾氧化生成二氧化碳气体,影响被提纯物质,故A错误;
B.醛基具有强还原性,但羰基不具有强还原性,含有羰基的有机物不一定能与银氨溶液发生银镜反应,如丙酮,故B错误;
C.苯、乙烯的平面形结构,则苯乙烯分子中所有原子可能在一个平面上,故C正确;
D.甲酸含有羧基,具有酸性,可用碳酸氢钠溶液鉴别,故D错误.
故选C.
点评 本题综合考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构特点以及官能团的性质,难度不大.

练习册系列答案
相关题目
16.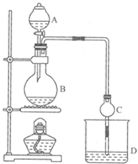 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸铵,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸铵,D中放有饱和碳酸钠溶液.
已知:①无水氯化钙可与乙醇形成难溶于水CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用:制乙酸、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示
18O位置的化学方程式:CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
(2)球形干燥管C的作用是防止倒吸、冷凝反应前向D中加入几滴酚酞,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)反应的理想温度范围在77.1-78.5℃,原因是使乙酸乙酯分离出来,防止混入杂质.因此,该装置需要改进的地方是水浴加热.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸铵,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸铵,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:制乙酸、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示
18O位置的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O(2)球形干燥管C的作用是防止倒吸、冷凝反应前向D中加入几滴酚酞,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)C;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)反应的理想温度范围在77.1-78.5℃,原因是使乙酸乙酯分离出来,防止混入杂质.因此,该装置需要改进的地方是水浴加热.
17.下列关于化学键的叙述,正确的一项是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 非金属元素组成的化合物中只含共价键 | |
| D. | 含有共价键的化合物一定是共价化合 |
11.下列有关第三周期主族元素的性质,从左到右递变规律不正确的是( )
| A. | 原子半径逐渐减小 | B. | 最高正化合价逐渐增大 | ||
| C. | 电子层数逐渐增多 | D. | 元素的非金属性逐渐增强 |
18.填写下表:
| 化学反应 | 能量转化形式 |
| ①CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | 由 化学能转化为 热能 |
| ②Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O | 由 化学能转化为 电能 |
| ③CaCO3$\frac{\underline{\;高温\;}}{\;}$Ca+CO2↑ | 由 热能转化为 化学能 |
| ④6nH2O+6nCO2$→_{叶绿素}^{光}$(C6H12O6)n+6nO2 | 由 光能转化为 化学能 |
15.在乙醇发生的各种反应中,断键方式不正确的是( )


| A. | 与钠反应① | B. | 在铜催化下加热①③ | ||
| C. | 在浓硫酸170°C条件下加热②③ | D. | 与HCl反应生成氯乙烷② |
16.CO2和CH4是两种重要的温室气体,通过化学反应可以将它们转化为其他物质.
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802.0kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=+247.6kJ•mol-1.
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数与温度的关系如下表:
①该反应的平衡常数表达式为K=$\frac{{c}^{2}(CO){c}^{2}({H}_{2})}{c(C{O}_{2})c(C{H}_{4})}$.
②k1、K2的关系是K1<K2.(填写“>”、“<”或“=”)
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(4)以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应式为CO2+8e-+6H2O=CH4+8OH-.

(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1=-802.0kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H2=-41.2kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H3=-566.0kJ•mol-1
反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=+247.6kJ•mol-1.
(2)在一定条件下,CH4和CO2以镍合金为催化剂,发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),其平衡常数与温度的关系如下表:
| 温度/℃ | 200℃ | 250℃ | 300℃ |
| 平衡常数/(mol•L-1)2 | K1 | K2 | 80 |
②k1、K2的关系是K1<K2.(填写“>”、“<”或“=”)
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①催化剂的催化效率与乙酸的生成速率随温度的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(4)以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应式为CO2+8e-+6H2O=CH4+8OH-.
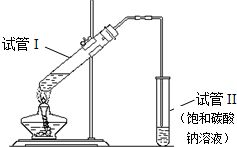 用如图所示的实验装置制备少量乙酸乙酯.请回答有关问题:
用如图所示的实验装置制备少量乙酸乙酯.请回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.