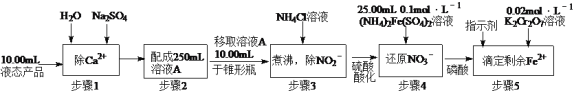
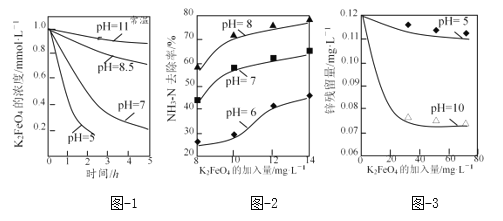
题目内容
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. 通入CO后,正反应速率逐渐增大
C. 反应前H2S物质的量为7mol
D. CO的平衡转化率为80%
【答案】C
【解析】
A.升高温度,H2S浓度增加,说明平衡逆向移动,则该反应是放热反应,A错误;B.通入CO后,正反应速率瞬间增大,又逐渐减小,B错误;C. 根据
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
起始物质的量(mol) 10 n 0 0
变化物质的量(mol) 2 2 2 2
平衡物质的量(mol) 8 n-2 2 2
设该容器的体积为V,根据K=0.1,列关系式得 [(2÷V)×(2÷V))÷[(8÷V)×(n-2)÷V]=0.1,解得n=7,C正确;D.根据上述数据CO的平衡转化率为2÷10×100%=20%,D错误;答案选C。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0