题目内容
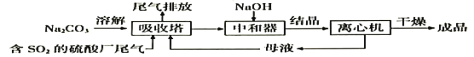
【题目】NaH2PO2(次磷酸钠)易溶于水,水溶液近中性,具有强还原性,可用于化学镀银、镍、铬等。一种利用泥磷(含P4和少量CaO、Fe2O3、Al2O3、CaCl2等)为原料制备NaH2PO2·H2O的工艺流程如下:

已知P4与两种碱的反应主要有:
Ⅰ. 2Ca(OH)2+P4+4H2O=2Ca(H2PO2)2+2H2↑
Ⅱ. 4NaOH + P4+8H2O = 4NaH2PO2·H2O+2H2↑
Ⅲ. 4NaOH + P4+2H2O = 2Na2HPO3 +2PH3↑
Ⅳ. NaH2PO2+NaOH = Na2HPO3+H2↑
(1)尾气中的PH3被NaClO溶液吸收生成NaH2PO2和NaCl的离子方程式为_____。
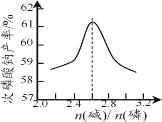
(2)“反应”在温度和水量一定时,混合碱总物质的量与P4的物质的量之比[n(碱)/ n(磷)]与NaH2PO2产率的关系如图所示。当n(碱)/ n(磷)>2.6时,NaH2PO2的产率随n(碱)/ n(磷)的增大而降低的可能原因是_____。
(3)通CO2“调pH”至溶液的pH约为_____,滤渣2主要成分为_____(填化学式)。
(4)“过滤2”的滤液须用Ag2SO4、Ba(OH) 2及Na2S溶液除去其中Cl-及Fe2+等,其中加入的Ag2SO4溶液不宜过量太多,其主要原因是_____。
(5)用NiCl2、NaH2PO2溶液化学镀Ni,同时生成H3PO4和氯化物的化学方程式为_____。
【答案】PH3 + 2ClO-+OH-= H2PO2-+2Cl-+H2O 过量的碱将NaH2PO2转化为Na2HPO3 7 CaCO3和Al(OH)3 过量的Ag+会氧化H2PO2- 2NiCl2 + NaH2PO2 + 2H2O= 2Ni↓ + H3PO4 + NaCl + 3HCl
【解析】
(1)根据题中所给信息,PH3与NaClO反应生成NaH2PO2和NaCl,PH3作还原剂,NaClO为氧化剂,其离子反应方程式为PH3+2ClO-+OH-=H2PO2-+2Cl-+H2O;
(2)n(碱)/n(磷)>2.6,说明碱过量,根据P4与两种碱反应中IV,H2PO2-与过量的NaOH反应转化成HPO32-,次磷酸钠的产率降低,因此NaH2PO2的产率随n(碱)/n(磷)的增大而降低的可能的原因是过量的碱将NaH2PO2转化为Na2HPO3 ;
(3)根据流程“反应”步骤中通入碱,以及NaH2PO2易溶于水,水溶液近中性,因此通入CO2的目的是调节pH,得到NaH2PO2溶液,其pH约为7;根据泥磷的成分,“反应”过程中加入足量碱,然后过滤,滤渣1中含有铁元素,“调pH”除去Ca2+和Al3+,CO2与碱反应生成CO32-,CO32-与Ca2+反应生成CaCO3,Al3+转化成Al(OH)3,因此滤渣2的成分是CaCO3和Al(OH)3;
(4)NaH2PO2具有强还原性,Ag+具有强氧化性,因此加入Ag2SO4溶液不易过量的主要原因是过量Ag+会氧化H2PO2-;
(5)根据题意,NiCl2中Ni转化成Ni单质,NaH2PO2为还原剂,P元素的化合价升高,NiCl2+NaH2PO2→Ni↓+H3PO4+NaCl,依据化合价升降法进行配平,即2NiCl3+NaH2PO2→2Ni↓+H3PO4+NaCl,产物为H3PO4,说明该溶液为酸性,利用原子守恒配平其他,即化学方程式为2NiCl2 + NaH2PO2 + 2H2O= 2Ni↓ + H3PO4 + NaCl + 3HCl;

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案【题目】下表中各组物质不能实现如图转化的是
![]()
选项 | 甲 | 乙 | 丙 |
A | CO2 | NaHCO3 | Na2CO3 |
B | AlCl3 | Al2O3 | NaAlO2 |
C | SiCl4 | SiO2 | Na2SiO3 |
D | AlCl3 | Al | NaAlO2 |
A. AB. BC. CD. D
【题目】I 充满HCl(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)该滴定实验盛装标准液的仪器是__________, 若该仪器的量程为50mL,调液面为0,将该仪器中所有液体放出,则放出的溶液体积_______50mL。(填“>”,“=”,“<”)
(2)若该滴定实验用酚酞做指示剂,达到滴定终点时,溶液颜色从____色变为____色且保持30s内不变色。
(3)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是第______种。
①5.000 mol/L ②0. 5000 mol/L ③0.0500 mol/L
(4)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
实验编号 | 待测盐酸的体积(mL) | 滴入氢氧化钠溶液的体积(mL) |
1 | 20.00 | 17.30 |
2 | 20.00 | 17.02 |
3 | 20.00 | 16.98 |
求测得的稀盐酸的物质的量浓度为_________________________。
II 测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式______________。
(2)判断滴定终点的方法是______。
(3)计算:血液中含钙离子的浓度为____g·mL-1。