题目内容
【题目】高铁酸盐等具有强氧化性,溶液pH越小氧化性越强,可用于除去废水中的氨氮、重金属等。
(1)用Na2O2与FeSO4干法制备Na2FeO4的反应历程中包含的热化学方程式有:
2FeSO4(s)+ Na2O2(s) = Fe2O3(s)+Na2SO4(s)+SO3(g) ![]() H1=akJ·mol-1
H1=akJ·mol-1
2 Fe2O3(s)+2 Na2O2(s) =4NaFeO2(s)+ O2(g) ![]() H2=bkJ·mol-1
H2=bkJ·mol-1
2SO3(g) +2Na2O2(s) =2Na2SO4(s)+ O2(g) ![]() H3=ckJ·mol-1
H3=ckJ·mol-1
2NaFeO2(s)+3Na2O2(s) =2Na2FeO4(s)+2Na2O(s) ![]() H4=dkJ·mol-1
H4=dkJ·mol-1
则反应2FeSO4(s) + 6Na2O2(s) =2Na2FeO4(s)+2Na2O(s)+2Na2SO4(s) + O2(g)的![]() H=_____kJ·mol-1(用含a、b、c、d的代数式表示);该反应中,每生成1mol Na2FeO4转移电子数为_____mol。
H=_____kJ·mol-1(用含a、b、c、d的代数式表示);该反应中,每生成1mol Na2FeO4转移电子数为_____mol。
(2)J.C.Poggendor早在1841年利用纯铁作电极插入浓的NaOH溶液电解制得Na2FeO4,阳极生成FeO42-的电极反应式为_____;Deinimger等对其进行改进,在阴、阳电极间设置阳离子交换膜,有效提高了产率,阳离子交换膜的作用是_____。
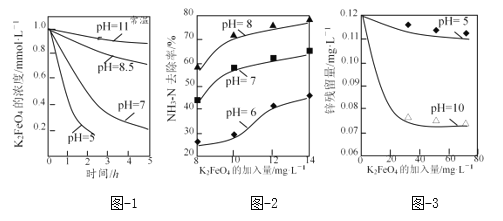
(3)K2FeO4的稳定性与pH关系如图-1所示,用K2FeO4去除某氨氮(NH3-N)废水,氨氮去除率与pH关系如图-2;用K2FeO4处理Zn2+浓度为0.12mg·L—1的含锌废水{Ksp[Zn(OH)2]=1.2×10-17},锌残留量与pH关系如图-3所示(已知:K2FeO4与H2O反应生成Fe(OH)3的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀)。
①pH=11时,K2FeO4与H2O反应生成Fe(OH)3和O2等物质的离子方程式为_____。
②图-2中:pH越大氨氮的去除率也越大,其原因可能是_____。
③图-3中:pH=10时锌的去除率比pH=5时大得多,其原因是_____(从锌的存在形态的角度说明)。
【答案】【答题空1】(2a+b+c+2d)/2 【答题空2】5 【答题空3】Fe + 8OH――6e-= FeO42-+4H2O 避免FeO42-在阴极上被还原 【答题空5】4FeO42-+ 10H2O = 4Fe(OH)3↓ + 3O2↑ + 8OH- 【答题空6】高铁酸盐在酸性较强时不稳定,容易分解,与污染物作用的时间短(以及在酸性条件下,氨氮主要以NH4+的形成存在,具有较稳定结约,还原性比NH3弱) 在pH为5时,锌以Zn2+存在;在pH=10时,锌几乎都以Zn(OH)2存在,并被高铁酸盐分解的产物Fe(OH)3捕集
【解析】
(1)①2FeSO4(s)+ Na2O2(s) = Fe2O3(s)+Na2SO4(s)+SO3(g),②2 Fe2O3(s)+2 Na2O2(s) =4NaFeO2(s)+ O2(g),③ 2SO3(g) +2Na2O2(s) =2Na2SO4(s)+ O2(g),④ 2NaFeO2(s)+3Na2O2(s) =2Na2FeO4(s)+2Na2O(s),根据目标反应方程式,(2×①+②+③+2×④)/2,推出△H=(2a+b+c+2d)/2kJ·mol-1;根据反应方程式,FeSO4中Fe的化合价升高,部分Na2O2中的O化合价升高,因此生成1molNa2FeO4转移电子物质的量(1mol×4+1/2mol×2×1)=5mol;
(2)根据电解原理,以及实验目的,Fe作阳极,电解质为NaOH,因此阳极反应式为Fe-6e-+8OH-=FeO42-+4H2O;阳离子交换膜只允许阳离子通过,FeO42-具有强氧化性,在阴极上得电子,因此阳离子交换膜的作用是防止FeO42-在阴极上被还原;
(3)①K2FeO4与H2O反应生成Fe(OH)3和O2,溶液pH=11为碱性,其离子方程式为4FeO42-+10H2O=4Fe(OH)3↓+3O2↑+8OH-;
②高铁酸盐具有强氧化性,可用于除去废水中的氨氮,根据信息,高铁酸盐在酸性和中性条件下不稳定,在碱性条件下稳定,因此pH越大氨氮的去除率也越大的原因可能是高铁酸盐在酸性较强时不稳定,容易分解,与污染物作用的时间较短,或者是在酸性条件下,氨氮主要以NH4+形式存在,具有较稳定结果,还原性比NH3弱;
③K2FeO4与H2O反应生成Fe(OH)3的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀,pH=10时锌的去除率比pH=5时大得多,其原因是在pH为5时,锌以Zn2+存在;在pH=10时,锌几乎都以Zn(OH)2存在,并被高铁酸盐分解的产物Fe(OH)3捕集;

 每课必练系列答案
每课必练系列答案【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g) ![]() 2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) △H=-92.6 kJ·mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量变化的数值 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q(Q>0)kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2mol·L-1
C. 容器②中反应达到平衡时放出的热量为Q kJ
D. 若容器①体积为 0.20 L,则达平衡时放出的热量大于23.15 kJ

