题目内容
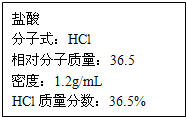 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度为
11.9
11.9
mol?L-1.(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是
BD
BD
.A.溶液中HCl的物质的量; B.溶液的浓度
C.溶液中Cl-的数目; D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL 物质的量浓度为0.3mol?L-1的稀盐酸.
①该学生需要量取
12.6
12.6
mL上述浓盐酸进行配制.②配置过程中,需要使用的仪器是(填写代号)
ABFGH
ABFGH
.A.烧杯; B.量筒; C.1000mL容量瓶; D.托盘天平
E.药匙; F.500mL容量瓶; G.胶头滴管; H.玻璃棒
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)
BCAFED
BCAFED
;A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
④在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是
BD
BD
.A.用量筒量取浓盐酸时俯视观察凹液面
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻度线
D.在配置前用已知浓度的稀盐酸润洗容量瓶
(4)现将100mL 0.5mol/L的盐酸和200mL 0.1mol/L CuCl2溶液混合,体积变化忽略不计,所得溶液中Cl-的物质的量浓度是
0.3mol/L
0.3mol/L
.分析:(1)设溶液的体积为VL,再求出溶质的物质的量,代入公式求出物质的量浓度;
(2)溶液的浓度和密度与溶液的体积多少之间没有关系;
(3)①根据稀释前后溶液中溶质的物质的量不变来计算;
②根据实验所用的仪器来回答;
③实验的步骤是:计算、量取、稀释、移液、洗涤、移液、定容、摇匀、贴签;
④根据公式c=
来确定实验误差;
(4)根据公式c=
来计算氯离子的浓度大小.
(2)溶液的浓度和密度与溶液的体积多少之间没有关系;
(3)①根据稀释前后溶液中溶质的物质的量不变来计算;
②根据实验所用的仪器来回答;
③实验的步骤是:计算、量取、稀释、移液、洗涤、移液、定容、摇匀、贴签;
④根据公式c=
| n |
| V |
(4)根据公式c=
| n |
| V |
解答:解:(1)设盐酸的体积为VL,则溶质的质量为V×1000mL×1.19g?cm-3×36.5%,溶质的物质的量为
=11.9Vmol,所以溶质的物质的量浓度为11.9mol/L,故答案为:11.9;
(2)溶液的浓度和密度与溶液的体积大小之间没有关系,溶液中HCl的物质的量和氯离子的数目和溶液的体积是成正比例关系的,故选BD;
(3)①设配制500mL物质的量浓度为0.3mol?L-1的稀盐酸需要11.9mol?L-1的盐酸的体积是V,则500mL×0.3mol?L-1=V×11.9mol?L-1,解得V=12.6mL,
故答案为:12.6;
②配制过程中,需要使用的仪器是烧杯、玻璃棒、量筒、一定体积的容量瓶,胶头滴管等,故答案为:ABFGH;
③配制时,其操作顺序是计算、量取、稀释、移液、洗涤、移液、定容、摇匀、贴签,故答案为:BCAFED;
④A.用量筒量取浓盐酸时俯视观察凹液面,实际量得的浓盐酸量偏少,所以结果偏低,故A错误;
B.溶液注入容量瓶前没有恢复到室温就进行定容,液体热胀冷缩,所加水量偏少,浓度偏高,故B正确;
C.定容时仰视刻度线,所加水量偏多,浓度偏小,故C错误;
D.在配置前用已知浓度的稀盐酸润洗容量瓶,相当于容量瓶中盐酸量多于实际量,结果偏高,故D正确.
故选BD;
(4)将100mL 0.5mol/L的盐酸和200mL 0.1mol/L CuCl2溶液混合,根据公式c=
=
=0.3mol/L,故答案为:0.3mol/L.
| V×1000mL×1.19g?cm-3×36.5% |
| 36.5mol/L |
(2)溶液的浓度和密度与溶液的体积大小之间没有关系,溶液中HCl的物质的量和氯离子的数目和溶液的体积是成正比例关系的,故选BD;
(3)①设配制500mL物质的量浓度为0.3mol?L-1的稀盐酸需要11.9mol?L-1的盐酸的体积是V,则500mL×0.3mol?L-1=V×11.9mol?L-1,解得V=12.6mL,
故答案为:12.6;
②配制过程中,需要使用的仪器是烧杯、玻璃棒、量筒、一定体积的容量瓶,胶头滴管等,故答案为:ABFGH;
③配制时,其操作顺序是计算、量取、稀释、移液、洗涤、移液、定容、摇匀、贴签,故答案为:BCAFED;
④A.用量筒量取浓盐酸时俯视观察凹液面,实际量得的浓盐酸量偏少,所以结果偏低,故A错误;
B.溶液注入容量瓶前没有恢复到室温就进行定容,液体热胀冷缩,所加水量偏少,浓度偏高,故B正确;
C.定容时仰视刻度线,所加水量偏多,浓度偏小,故C错误;
D.在配置前用已知浓度的稀盐酸润洗容量瓶,相当于容量瓶中盐酸量多于实际量,结果偏高,故D正确.
故选BD;
(4)将100mL 0.5mol/L的盐酸和200mL 0.1mol/L CuCl2溶液混合,根据公式c=
| n |
| V |
| 0.1L×0.5mol/L+0.2L×0.1mol/L×2 |
| 0.3L |
点评:本题考查了一定物质的量浓度溶液的配制,难度不大,学会根据物质的量浓度公式来判断配制溶液的浓度偏大还是偏小是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: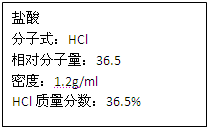 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题: