题目内容
8.下列有关实验操作、实验现象或实验结论的描述正确的是( )| A. | 做一次完整的中和热的测定实验,至少需要使用温度计测4次数据 | |
| B. | 向酸性重铬酸钾溶液中少量加NaOH固体,溶液颜色由橙色慢慢变为黄色 | |
| C. | 分别向两支盛有浓度相等的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液,观察到前者产生气泡不如后者剧烈 | |
| D. | 在0.01mol/L的KMnO4溶液中加入0.1mol/L的H2C2O4溶液,实验开始时溶液褪色很快,后来逐渐变慢,主要是由于溶液浓度变化所致 |
分析 A.中和热测定实验中需要温度计测量酸、碱和反应后的最高温度三次;
B.重铬酸钾溶液中存在平衡Cr2O72-(橙红色)+H2O?2H++2CrO42-(黄色);
C.硼酸和碳酸钠不反应;
D.在0.01mol/L的KMnO4溶液中加入0.1mol/L的H2C2O4溶液,实验开始时褪色较慢,一段时间后褪色较快,后来再变慢.
解答 解:A.中和热测定实验中需要温度计测量酸、碱和反应后的最高温度三次,所以至少需要使用温度计测3次数据,故A错误;
B.重铬酸钾溶液中存在平衡Cr2O72-(橙红色)+H2O?2H++2CrO42-(黄色),加入NaOH,中和生成的氢离子,从而促进重铬酸根离子水解,导致溶液呈黄色,故B正确;
C.硼酸和碳酸钠不反应,所以硼酸和碳酸钠混合不产生气体,故C错误;
D.在0.01mol/L的KMnO4溶液中加入0.1mol/L的H2C2O4溶液,实验开始时褪色较慢,一段时间后褪色较快,生成的锰离子作催化剂加快反应速率,随着反应进行浓度降低而导致速率后来再变慢,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器使用、盐类水解、反应速率影响因素等知识点,明确实验原理、物质性质是解本题关键,易错选项是D.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 标况下11.2LSO3含有的分子数为0.5 NA | |
| B. | 标况下1mol氖气含有的原子数为2NA | |
| C. | 常温常压71gCl2所含原子数为NA | |
| D. | 17g氨气所含电子数目为10NA |
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 氯化氢的摩尔质量等于NA个氯分子和NA个氢分子的质量之和 | |
| B. | 常温常压下,11.2 L氢气中含有氢原子数为NA | |
| C. | 含有溶质为0.5molMgCl2的溶液中含有Cl-离子数为NA | |
| D. | 32 g氧气中含有氧原子数为NA |
3.下列物质中,既能跟NaOH反应,又能跟盐酸反应的是( )
| A. | (NH4)2 SO4 | B. | Al(OH)3 | C. | NaHSO4 | D. | Mg(NO3)2 |
13.下列对有关实验操作的叙述错误的是( )
| A. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 配置一定物质的量浓度溶液转移操作时玻璃棒下端抵在容量瓶刻度线处 |
17.下列各项的说法中正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 反应是放热或吸热,必须看反应物和生成物所具有的总能量的相对大小 | |
| D. | 分子中键能越大则分子能量越高,分子越稳定 |
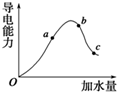 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: