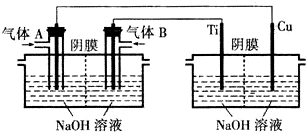
题目内容
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 氯化氢的摩尔质量等于NA个氯分子和NA个氢分子的质量之和 | |
| B. | 常温常压下,11.2 L氢气中含有氢原子数为NA | |
| C. | 含有溶质为0.5molMgCl2的溶液中含有Cl-离子数为NA | |
| D. | 32 g氧气中含有氧原子数为NA |
分析 A、摩尔质量的数值为g/mol;
B、常温常压下,气体摩尔体积为22.4L/mol;
C、1mol氯化镁中含2mol氯离子;
D、氧气由氧原子构成.
解答 解:A、摩尔质量的数值为g/mol,故HCl的摩尔质量为36.5g/mol,而NA个氯分子和NA个氢分子的质量之和为73g,故A错误;
B、常温常压下,气体摩尔体积为22.4L/mol,故11.2L氢气的物质的量小于0.5mol,则氢原子个数小于NA个,故B错误;
C、1mol氯化镁中含2mol氯离子,故0.5mol氯化镁中含NA个氯离子,故C正确;
D、氧气由氧原子构成,故32g氧气中含有的氧原子的物质的量n=$\frac{32g}{16g/mol}$=2mol,个数为2NA个,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
17.某小组取一定质量的FeSO4固体,利用如图装置进行实验.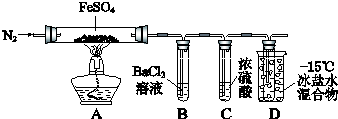
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃.
(1)加热前,先通入一段时间N2的目的是排除装置内空气,防止硫酸亚铁被氧气氧化.
(2)实验③反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
(3)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有SO2气体.依据是因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原.因此一定有SO2生成.
(4)实验④反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.

已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8℃.
| 实验过程 | 实验现象 | |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
(2)实验③反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
(3)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有SO2气体.依据是因为有Fe2O3生成,在FeSO4中只有+6价S元素有氧化性,能被还原.因此一定有SO2生成.
(4)实验④反应的离子方程式是2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
4.下列气体的干燥和吸收方法正确的是( )
| A. | 氨气可以用五氧化二磷干燥 | |
| B. | 氮气和氢气反应合成氨气由于反应物转化率较低,用水吸收该混合气体中的氨气不用防倒吸 | |
| C. | 浓硫酸不能干燥硫化氢气体,应该用碱石灰 | |
| D. | 制得的氯气中混有杂质氯化氢气体可用饱和碳酸氢钠溶液吸收 |
11.下列叙述(1)和(2)均正确并且有因果关系的是( )
| A. | Na2S有强还原性(1)用于除去废水中的Cu2+ 和Hg2+(2) | |
| B. | CaCO3是难容物(1)CaCO2溶液中通入CO2产生白色沉淀(2) | |
| C. | 浓HSO4有强氧化性(1),浓H2SO4可用于干燥SO2(2) | |
| D. | Zn具有还原性和导电性(1)可用锌锰干电池的负极材料(2) |
8.下列有关实验操作、实验现象或实验结论的描述正确的是( )
| A. | 做一次完整的中和热的测定实验,至少需要使用温度计测4次数据 | |
| B. | 向酸性重铬酸钾溶液中少量加NaOH固体,溶液颜色由橙色慢慢变为黄色 | |
| C. | 分别向两支盛有浓度相等的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液,观察到前者产生气泡不如后者剧烈 | |
| D. | 在0.01mol/L的KMnO4溶液中加入0.1mol/L的H2C2O4溶液,实验开始时溶液褪色很快,后来逐渐变慢,主要是由于溶液浓度变化所致 |
6.某同学欲配制0.55mo1•L-1的NaOH溶液200mL(存在200mL容量瓶).称量操作如下:
①先用托盘天平称量烧杯的质量.称量前先调节天平零点.用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码.取用砝码情况和游码读数如表:

烧杯的质量为33.2g.
②称量烧杯和NaOH固体的质量.再在天平右盘上放置5g砝码,将游码的位置移到2.6g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡.
①先用托盘天平称量烧杯的质量.称量前先调节天平零点.用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码.取用砝码情况和游码读数如表:
| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |

烧杯的质量为33.2g.
②称量烧杯和NaOH固体的质量.再在天平右盘上放置5g砝码,将游码的位置移到2.6g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡.