题目内容
17.下列各项的说法中正确的是( )| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 反应是放热或吸热,必须看反应物和生成物所具有的总能量的相对大小 | |
| D. | 分子中键能越大则分子能量越高,分子越稳定 |
分析 A、反应吸放热与反应条件无关;
B、放热反应很多需要加热才能发生;
C、反应的热效应取决于反应物和生成物的总能量的大小;
D、分子越稳定,则能量越低.
解答 解:A、反应吸放热与反应条件无关,故需要加热才能发生的反应不一定是吸热反应,如煤炭的燃烧,故A错误;
B、放热反应很多需要加热才能发生,在常温下不一定容易发生,故B错误;
C、反应的热效应取决于反应物和生成物的总能量的大小,当反应物的总能量大于生成物的总能量时,反应放热,反之吸热,故C正确;
D、分子中的键能越大,则物质越稳定,而分子越稳定,则能量越低,故D错误.
故选C.
点评 本题考查了反应吸放热的判断,应注意的是反应吸放热与反应条件无关,即吸热反应不一定需要加热,放热反应不一定不需要加热.

练习册系列答案
相关题目
8.下列有关实验操作、实验现象或实验结论的描述正确的是( )
| A. | 做一次完整的中和热的测定实验,至少需要使用温度计测4次数据 | |
| B. | 向酸性重铬酸钾溶液中少量加NaOH固体,溶液颜色由橙色慢慢变为黄色 | |
| C. | 分别向两支盛有浓度相等的醋酸和饱和硼酸溶液中滴加等浓度的Na2CO3溶液,观察到前者产生气泡不如后者剧烈 | |
| D. | 在0.01mol/L的KMnO4溶液中加入0.1mol/L的H2C2O4溶液,实验开始时溶液褪色很快,后来逐渐变慢,主要是由于溶液浓度变化所致 |
12.下列实验操作中数据合理的是( )
| A. | 用100mL容量瓶配制50mL 0.1mol/L的盐酸 | |
| B. | 用10mL 量筒量取5.2mL盐酸 | |
| C. | 用托盘天平称取25.12g NaCl固体 | |
| D. | 用pH试纸测得某溶液的pH值为12.5 |
6.某同学欲配制0.55mo1•L-1的NaOH溶液200mL(存在200mL容量瓶).称量操作如下:
①先用托盘天平称量烧杯的质量.称量前先调节天平零点.用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码.取用砝码情况和游码读数如表:

烧杯的质量为33.2g.
②称量烧杯和NaOH固体的质量.再在天平右盘上放置5g砝码,将游码的位置移到2.6g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡.
①先用托盘天平称量烧杯的质量.称量前先调节天平零点.用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码.取用砝码情况和游码读数如表:
| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |

烧杯的质量为33.2g.
②称量烧杯和NaOH固体的质量.再在天平右盘上放置5g砝码,将游码的位置移到2.6g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡.
7.下列属于酸性氧化物的是( )
| A. | CO2 | B. | CaO | C. | K2SO4 | D. | NaOH |
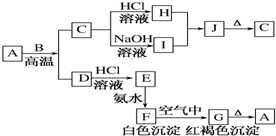 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.