题目内容
【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3 , 其流程如下: 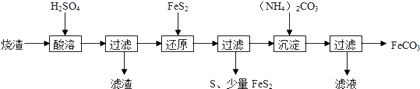
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+
(1)加入FeS2还原后,检验Fe3+是否反应完全的试剂为 .
(2)所得FeCO3需充分洗涤,检验是否洗净的方法是 . “沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是 .
(3)①写出“还原”时反应Ⅱ的离子方程式: .
(4)②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
离子 | 离子浓度(molL﹣1) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.5 |
SO42﹣ | 3.5 | 3.7 |
请计算反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比(写出计算过程).
【答案】
(1)KSCN溶液
(2)取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净;氢氧化铁
(3)2Fe3++S2﹣=2Fe2++S↓
(4)解:根据表可知,反应Ⅰ中生成的硫酸根的浓度为0.2molL﹣1,据反应FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+可知,反应Ⅰ中被还原的Fe3+的物质的量浓度为1.4molL﹣1,同时计算出生成的亚铁离子的浓度为1.5molL﹣1,两个反应中共生成的亚铁离子的浓度为2.4molL﹣1,所以反应Ⅱ中生成的亚铁离子浓度为0.9molL﹣1,根据2Fe3++S2﹣=2Fe2++S↓可知,Ⅱ中被还原的Fe3+的物质的量浓度为0.9molL﹣1,所以反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为1.4molL﹣1:0.9molL﹣1=14:9,
答:反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为14:9
【解析】解:烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)用硫酸浸取,过滤后滤液中含有硫酸铁、硫酸亚铁、未反应的硫酸,滤渣为二氧化硅,用二硫化亚铁矿还原Fe3+后过滤,得滤液中含有硫酸亚铁,向滤液中加入碳酸铵,过滤得碳酸亚铁,滤液中有硫酸铵,(1)检验Fe3+常用KSCN溶液,看溶液是否呈血红色,所以检验Fe3+是否反应完全的试剂为KSCN溶液,
所以答案是:KSCN溶液;(2)过滤得碳酸亚铁,滤液中有硫酸铵,所以检验FeCO3是否洗净,就是检验洗涤滤液中是否有硫酸根离子,所以操作为取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净,“沉淀”时,pH过高时溶液中的亚铁离子会生成氢氧化亚铁,进而生成氢氧化铁,
所以答案是:取最后一次洗涤滤液,滴加氯化钡溶液,看溶液是否有沉淀,若无沉淀,则已经洗涤干净;氢氧化铁;(3)①根据流程可知,“还原”时反应Ⅱ有硫产生,应为硫离子与铁离子之间的氧化还原反应,反应的离子方程式为2Fe3++S2﹣=2Fe2++S↓,
所以答案是:2Fe3++S2﹣=2Fe2++S↓;

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)其原子只要形成一对共用电子对就达到了稳定结构的元素是(填写元素符号).
(2)①和④号元素形成的化合物的化学式为 , 用电子式表示其形成过程为 .
(3)⑧号元素的最高价氧化物的水化物的化学式是 .
(4)①、⑤、⑦号元素形成的一种化合物的电子式是 , 在该化合物中既含有键,又含有键.