题目内容
【题目】碘是人类发现的第二个生命体必须微量元素,回答下列问题:
(1)碘是氯的同族元素,它们位于元素周期表第族;HI的稳定性比HCl(填“强”或“弱”,下同),HI的还原性比HCl
(2)为了从海带中提取碘,某研究性学习小组设计并进行了如图实验: 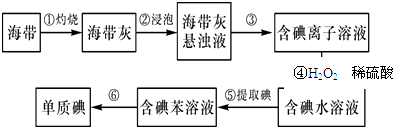
步骤①需要在(填仪器名称)中进行.步骤④反应的离子方程式是 . 步骤⑤中应进行的操作名称是
(3)自然界中的碘有的以NaIO3形态,加入NaHSO4可以制得I2 , 反应为:(未配平)IO3﹣+HSO3﹣→I2+SO42﹣+H++H2O,若制得1mol I2 , 则转移的电子数目为
【答案】
(1)ⅦA;弱;强
(2)坩埚;H2O2+2I﹣+2H+═2H2O+I2;萃取 分液
(3)10NA
【解析】解:(1)氯原子结构图为 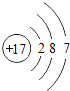 ,最外层7个电子,属于第ⅦA族元素,碘与氯是同族元素,所以它们位于元素周期表的第ⅦA族,同主族元素的非金属性越强,对应的氢化物越稳定,但氢化物的还原性越弱,F、Cl、Br、I属于同主族元素,所以HI的稳定性比HCl弱,HI的还原性比HCl强, 所以答案是:ⅦA;弱;强;(2)灼烧固体物质一般使用坩埚,碘离子在酸性条件下可被H2O2氧化成单质碘,H2O2被还原为水,反应的离子方程式为2I﹣+H2O2+2H+=I2+2H2O,第⑤步的操作是萃取、分液,用苯做萃取剂,分液后取上层,然后进行蒸馏获取碘单质,
,最外层7个电子,属于第ⅦA族元素,碘与氯是同族元素,所以它们位于元素周期表的第ⅦA族,同主族元素的非金属性越强,对应的氢化物越稳定,但氢化物的还原性越弱,F、Cl、Br、I属于同主族元素,所以HI的稳定性比HCl弱,HI的还原性比HCl强, 所以答案是:ⅦA;弱;强;(2)灼烧固体物质一般使用坩埚,碘离子在酸性条件下可被H2O2氧化成单质碘,H2O2被还原为水,反应的离子方程式为2I﹣+H2O2+2H+=I2+2H2O,第⑤步的操作是萃取、分液,用苯做萃取剂,分液后取上层,然后进行蒸馏获取碘单质,
所以答案是:坩埚;2I﹣+H2O2+2H+=I2+2H2O;萃取、分液;(3)IO3﹣+HSO3﹣→I2+SO42﹣+H++H2O反应中I元素的化合价从+5价降低到0价,得到5个电子,2个I原子得到10个电子,则S元素失去10个电子,依据得失电子守恒及原子个数守恒,方程式为:4NaIO3 +10NaHSO3 =7Na2SO4 +3H2SO4 +2I2+2H2O,离子方程式为:4IO3﹣+10HSO3﹣=2I2+10SO42﹣+6H++2H2O,2个I原子得到10个电子,制得1mol I2 , 转移10mol电子,即10NA ,
所以答案是:10NA .

【题目】某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)可用于制备FeCO3 , 其流程如下: 
已知:“还原”时,FeS2与H2SO4不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应Ⅰ如下:
FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+
(1)加入FeS2还原后,检验Fe3+是否反应完全的试剂为 .
(2)所得FeCO3需充分洗涤,检验是否洗净的方法是 . “沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是 .
(3)①写出“还原”时反应Ⅱ的离子方程式: .
(4)②“还原”前后溶液中部分离子的浓度见下表(溶液体积变化或略不计):
离子 | 离子浓度(molL﹣1) | |
还原前 | 还原后 | |
Fe2+ | 0.10 | 2.5 |
SO42﹣ | 3.5 | 3.7 |
请计算反应Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比(写出计算过程).